| kategória | ||||||||||
|
|
||||||||||
|
|
||
KÉMIAI KÖTÉSEK
Az elemek atomjai más elemek atomjaival reagálni képesek. Ezáltal az anyag fizikai és kémiai tulajdonságai megváltoznak. Az atomok összetartásához kémiai kötés szükséges. A tendencia, hogy egy vagy több kötés kialakításával a vegyértékhéj konfigurációja, elektroneloszlása megváltozzon.
Az elemek kémiai tulajdonságait elsösorban atomjaik protonszáma, ill. az ezáltal meghatározott elektronok száma és elrendezödése szabja meg. Legdöntöbb hatása ebben a tekintetben a vegyértékhéjnak van.
Az elemek és vegyületek a kémiai reakciók során, a vegyértékhéjon a nemesgáz szerkezet elérésére törekszenek, amely a héliumnál 1s2, a többinél s2p6, a neon, argon vagy kripton elektroneloszlásnak felel meg. A szerkezet energetikailag kedvezö és így stabil. Az elemek és vegyületek egy vagy több kötés kialakításával a nemesgáz szerkezet elérésére törekszenek, és ez az un. oktett szabály. A legfontosabb kötések jellegét az atomok vegyértékhéjában lévö elektronok száma, állapota, kölcsönhatása befolyásolja. Az atomok kapcsolódásának módozatait elsörendü kémiai kötéseknek nevezzük.
Az elektronegativitás az az erö, amellyel az atom a kötését létesítö elektronokat vonzza. Minél nagyobb két atom elektronegativitás különbsége, annál polárosabb, ionosabb jellegü a molekula, nagy elektronegativitás különbségnél molekuláról nem beszélhetünk, ionos kötés jön létre.
Az
atomok közötti kötés milyenségét alapvetöen meghatározza az atomok elektronegativitás összege, és
elektronegativitás különbsége. Alapszabály, hogy minél nagyobb az
elektronegativitás különbség, (EN) a kötés annál inkább ionos jel 111d32b legü. Általában ionosnak
nevezhetjük a kötést, ha EN
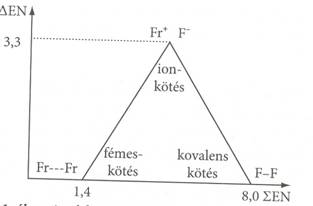
7. ábra. Az elektonnegativitások összege és különbsége közötti összefüggések és kötések kapcsolata
A kötést létesítö atomok elektronegativitás összege azt az eröt jellemzi, amely a kötést létrehozó elektronpárt (elektronpárokat) a két atomhoz köti; lokalizálja. Nagy elektronegativitás összeg esetén stabil kétatomos molekulák jönnek létre, ha az elektronegativitás összeg kicsi, a kötö elektronpár nem tud csak a két atomnál maradni, több atomra kiterjedö delokalizált kötés, többatomos molekulák jönnek létre.
Közös jellemzöjük, hogy kialakulásuk során az atomok vegyértékhéj szerkezete megváltozik, és a hozzájuk rendelhetö kötési energia 80 és 800 kJ/mol között van. A kötési energia az adott kémiai kötés felbomlásához szükséges, vagy a kötés létrejöttekor felszabaduló energia 1 mól anyagra vonatkoztatva. Az elsörendü kémiai kötések alaptípusai a következök: fémes-, ionos- és kovalens kötés. Ezek között különbözö átmenetek lehetségesek (pl. poláris kovalens kötés), ami az elemek eltérö elektronegativitásával magyarázható.
A kötések másik csoportját azok a kötöerök hozzák létre, amelyek az anyagi halmazok részecskéi között lépnek fel. Ezek a kötések a már lezárt molekulák között jönnek létre, és ezeknek csak a fizikai tulajdonságait határozzák meg. Másként fogalmazva az anyagi halmazokban másodrendü kötések alakulnak ki gyenge kölcsönhatások révén. Ide sorolhatók a hidrogénkötés (8-40 kJ/mol) és az elektrosztatikus elven megvalósuló London-féle erök csoportja (0,8-12 kJ/mol). A gyenge kölcsönhatások jelentösen befolyásolják az oldódási viszonyokat, a forráspontot és az egyéb fizikai tulajdonságokat, továbbá kiemelkedöen fontos szerepet játszanak az élö anyag müködése szempontjából.
Az elsödleges kémiai kötések
Az elsödleges kémiai kötések három alaptípusát a fémes, az ionos és a kovalens kötés alkotja, melyek között átmenetek is vannak.
Fémes kötés: ha az atomok között EN 2.0 és a ∑EN 2., akkor van lehetöség a kialakulására.
A fémes kötés létrehozását a fémek két különleges tulajdonsága teszi lehetövé:
* elektronvezetök, amely azt jelenti, hogy ha egy elektront valamely fém felvesz, annak egy másik helyéröl egy elektron kiléphet;
*valamely fém kristályrácsában minden fématomot nagyszámú, azonos jellegü atom vesz körül.
A fémek jellegzetes tulajdonságai a fémes fény, a szürke szín, a nyújthatóság és a kovácsolhatóság. Sürüségük néhány kivételtöl eltekintve viszonylag nagy, jól vezetik a höt és az elektromosságot, vékony szálakká, lemezekké nyújthatók. Kémiai reakciókban általában redukálószerek, ezért vegyületeiben pozitív fémionként találhatók.
Ezen tulajdonságokat magyarázza a fémes kötés ún. sávelmélete. A fémek többségében a legkülsö elektronhéjon (amely megfelel a legmagasabb energiaállapotnak), egy vagy két s elektron található. A fématomok közeledésével kialakul a fémekre jellemzö szoros illeszkedésü kristályszerkezet, melynek során a legkülsö héjon a vegyértékelektronok energiaszintjei módosulnak, és egymáshoz közelesö energiaszintü atompályák sorozata alakul ki. A lítium esetével magyarázva, a fémrács kialakulásának elsö lépése a két atomos "lítium molekula" (Li2) kialakulása. A lítiumatom elektronkonfigurációja 1s22s1, mely elektronokból csak a 2s1 vegyértékelektron vesz részt a kristályrács kialakításában.
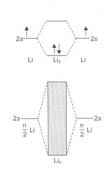
8. ábra. Az energiasáv képzödése a Li fémkristályba (Gergely, 2003)
Az atomorbitálok energiaszintje módosul, és két új energiaszintü molekulaorbitál jön létre. Ha igen sok lítium atom helyezkedik el a fémrácsban, akkor az új molekulaorbitálok energianívói energiasávot hoznak létre, melyben az elektronok viszonylag szabadon mozoghatnak, a pozitív töltésü fémionok pedig rögzítve találhatók a fémrácsban. A jó kovácsolhatóságra és nyújthatóságra magyarázat az, hogy a rácsszerkezet pozitív töltésü ionjai a fémes kötés gyengülése nélkül elmozdulhatnak. Az energiasávokban szabadon mozgó elektronok delokalizáltak (helyhez nem kötöttek), mindig kiegyenlítik a pozitív töltésü rétegek közötti taszítóeröket.
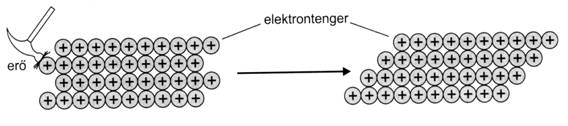
8. ábra. A fémek nyújthatósága
Az "elektrontenger" egymáshoz igen közel álló energiaszintü elektronjaival magyarázható a fémek átlátszatlansága és fémes szürke színe. Mivel nagyon sok fajta elektronátmenet lehetséges, ezért gyakorlatilag minden hullámhosszúságú fény abszorbeálódik, melynek következtében a fém átlátszatlan. A fémes fényt, valamint a fémek különbözö színét a kristályfelületen lévö delokalizált elektronok gerjesztését követö abszorbeált fény visszasugárzása okozza.
A fémek elektromos vezetöképességét ugyancsak magyarázni lehet a sávelmélettel, ill. a delokalizált elektronokkal. A fémkristályokban az energiasáv csak részben van betöltve elektronokkal, ezért feszültségkülönbség hatására az elektronok a sáv betöltetlen részébe kerülnek, és a gerjesztett elektronok elmozdulnak. Helyükön egy lyuk (hiány) marad vissza, ami azonban a szomszédos elektron átlépésével betöltödik, és egy újabb lyuk keletkezését vonja maga után. A lyuk tehát mindaddig végigvándorol, amíg azt egy külsö forrásból származó elektron be nem tölti. A lyuk és a gerjesztett elektron vándorlása ellentétes: az elektromos áram vezetése során a fémkristálynak sem a tömege, sem a töltése nem változik meg.
Magasabb rendszámú fémeknél a vegyértékelektronok sávjának kialakításában az üres p és d atomorbitálok is részt vehetnek. A fémek elektromos vezetöképessége a hömérséklet növekedésével csökken, melynek az a magyarázata, hogy a kristályrács fémionjainak nö az energiája, rezgö mozgásuk fokozódik, így a feszültségkülönbség hatására mozgó elektronokkal gyakrabban ütköznek, ami az ellenállást növeli. Alacsony hömérsékleten a szupravezetés akkor alakul ki, amikor a fémrács ionjai már alig fejtenek ki ellenállást a sávban mozgó elektronokkal szemben. A fémeknél a szupravezetés csak igen alacsony hömérsékleten (5 K alatt), míg kerámia-oxidokban már lényegesen magasabb hömérsékleten (30 -100 K között) is elöfordul.
Ionkötés: alakul ki, ha az atomok között a EN 2 feltétel teljesül és a ∑EN kb. 3-4 értéket tesz ki.
Az ionos szilárd anyagok kristályaiban pozitív és negatív töltésü ionok találhatók a rácspontokban. Az összetartó erö az ellentétes töltésü részecskék közötti elektrosztatikus vonzás. Kationok képzödéséhez ionizációs energia befektetésére van szükség, az anionok képzödése pedig legtöbbször energia felszabadulással jár.
A kevés vegyértékelektronnal rendelkezö fémeknek megvan a hajlama, hogy azt leadják. Ezáltal kationok keletkeznek, amelyek pozitív töltésüek, de a külsö héjuk nemesgáz szerkezetü, a szükséges energia az ionizációs energia. Pl. nátrium és magnézium ionok kialakulása
![]()
![]() Na -e- Na+ Mg -2e - Mg2+
Na -e- Na+ Mg -2e - Mg2+
1s2 2s2 2p6 3s1 1s2 2s22p6 1s2 2s2 2p6 3s2 1s2 2s2 2p6
Ei = 496kJ/mol Ei = 586 kJ/mol
Azon nem fémes elemek, amelyek vegyérték elektronhéjáról egy vagy két elektron hiányzik, hajlamosak elektron felvételére és így negatív töltésü ionok alakulnak ki. Pl.
![]()
![]() Cl + 1e - Cl- O + 2e- O2-
Cl + 1e - Cl- O + 2e- O2-
1s2 2s2 2p6 3s2 3p5 1s2 2s2 2p6 3s2 3p6 1s2 2s2 2p4 1s2 2s2 2p6
Eaff = - 349kJ/mol Eaff = + 704 kJ/mol
Az elsö elektron felvétele még energia felszabadulással jár, de a második felvétele már energia befektetést igényel.
A NaCl ionkristály kialakulása során a nátriumatom 3s-orbitálján lévö elektron eltávolításához ionizációs energia befektetésére van szükség (Ei > 0), miközben az atom mérete jelentösen csökken nátriumion keletkezése közben. Az ionizációs energia értéke 496 kJ/mol. A nátriumion keletkezésével párhuzamosan a klóratomból elektronfelvétellel kloridion képzödik. A folyamat energiafelszabadulással jár (Eaff = -349 kJ/mol), miközben a kloridion mérete jelentösen megnö.
A nátrium ionizációjához szükséges energiát nem fedezi a kloridion képzödésekor felszabaduló energia. A NaCl kristályrács kialakítása azonban további energia felszabadítással jár, mivel az ellentétes töltésü ionok az elektrosztatikus vonzóerö következtében közelednek egymáshoz, ionrácsot alkotnak, és potenciális energiájuk csökken. Ennek következtében a kloridionok képzödésekor (-349 kJ/mol), és a kristályrács kialakulásakor felszabaduló energia (-503 kJ/mol) már fedezi a nátriumion képzödéséhez szükséges energiát (+495 kJ/mol). Az ionkristály energiaállapota ennek következtében lényegesen kisebb, mint az eredeti atomoké. A nátrium-klorid kristály elemi egységét a 9. ábra mutatja.
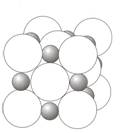
9. ábra. A nátrium-klorid kristály elemi egysége
A NaCl rácstípusa lapon centrált köbös. A rács középpontjában és az éleken van a kisebb méretü nátriumionok, míg a csúcsban és a lapok középpontjában a kloridionok.
Szilárd halmazállapotban az ionvegyületek sztöchiometriai arányú végtelen kristályrácsot alkotnak, nem pedig különálló molekulákat. Hevítésre azonban belölük különálló, a sztöchiometriai összetételnek megfelelö molekulák képzödnek és lépnek ki a gáztérbe.
Az ionok elektronkonfigurációját az
atom periódusos rendszerben elfoglalt helye határozza meg. Az s mezö
atomjai és az alumínium elektronleadással, a p mezö atomjainak többsége
elektronfelvétellel hoznak létre kationokat, illetve anionokat
nemesgáz-konfigurációval. Pl. a nátriumatom
A kationok kialakulása
méretcsökkenéssel, az anionoké méretnövekedéssel jár, amely méretbeni változás
összhangban van az ionokban lévö protonok és elektronok számának
arányával. Többatomos összetett ionokat a p mezö atomjainak kovalens
kötéssel kialakított anionjai alkotnak (![]() ,
,![]() ,
, ![]() ,
, ![]() ,
, ![]() ). A d mezö
fématomjai bonyolult szerkezetü anionokat képeznek (
). A d mezö
fématomjai bonyolult szerkezetü anionokat képeznek (![]() ,
, ![]() ,
, ![]() ).
).
Kovalens kötés: ha EN = 0, akkor apoláros kovalens kötésü molekula jön létre, de EN 0.5-ig gyakorlatilag apoláros a kötés.
A kovalens kötés kialakításakor a szabad atomokból molekulák jönnek létre, melyek ezzel stabilabb állapotba kerülnek, mivel a molekulák alacsonyabb energiájú rendszerek, mint a különálló atomok. A kovalens kötés esetében a vegyületet alkotó atomok párosítatlan spinü elektronjai páronként egy kovalens kötést hoznak létre. A kötés kialakításának egyik módja az, amikor mindkét kapcsolódó atom egy-egy elektront ad a kovalens kötést létesítendö elektronpár kialakításához. A kovalens kötésnek így kialakított módját kolligációnak nevezzük. Azok az elektronpárok, amelyek nem vesznek részt a molekula kötéseinek kialakításában a szabad- vagy nem kötö elektronpárok.
![]() Az így leírt Lewis-féle molekula szerkezetben az
elektronokat pontokkal, az elektronpárokat esetleg vonalakkal jelöljük: nem kötö-elektronpár
Az így leírt Lewis-féle molekula szerkezetben az
elektronokat pontokkal, az elektronpárokat esetleg vonalakkal jelöljük: nem kötö-elektronpár
![]()
:
A többszörös kovalens kötésü molekulában a kettös kovalens kötést két, a hármas kovalens kötést három vegyérték elektronpár jelöli:
:![]() ::C::
::C::![]() : H:CMMC:H
: H:CMMC:H
Vannak olyan molekulák és összetett ionok, melyek képzödésénél a kovalens kötést létesítö elektronpár mindkét elektronja ugyanattól az atomtól származik. Az elektronpárt szolgáltató atom a donor, másik az akceptor. A kötést donor-akceptor vagy koordinált (datív) kovalens kötésnek hívjuk. Kialakulásának feltétele, hogy a donoratomnak szabad elektronpárja vagy elektronpárjai legyenek, az akceptorban pedig minimum két elektron hiányozzon a vegyérték-elektronhéj lezártságához. Datív kötés létesül pl. akkor, amikor az ammónia a protonnal ammóniumiont hoz létre. Ekkor a nitrogénatom az elektronpárdonor, a proton pedig az elektronakceptor. A pozitív töltés eloszlik az egész ammóniumionra, ezért a kolligációs kötéssel kapcsolt hidrogénatomok nem különböztethetök meg a datív kovalens kötéssel kötött hidrogénatomtól. A datív kötésnek elsösorban a komplex vegyületek keletkezésénél van szerepe, ezért a komplexeket koordinációs vegyületeknek is hívják, mert koordinatív kovalens (azaz datív) kötések révén keletkeznek.
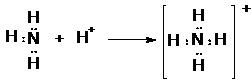
A kovalens kötés alkalmas óriásmolekulák létrehozására is. A gyémánt kristályrácsát pl. kizárólag szénatomok alkotják, mindegyik 4-4 szomszédos szénatommal létesít kovalens kötést. A kvarckristályokban a szilíciumatomok 4 oxigénatom közvetítésével kapcsolódnak újabb szilíciumatomokhoz. A kovalens kötések rendszere a molekulák egészére kiterjed, speciális fizikai és kémiai sajátságokat adva a vegyületeknek. Így pl. mindkét kristály magas olvadáspontú, kemény és az elektromosságot nem vezeti.
A kovalens kötéshossz és a kötési energiák
Az elektronok elrendezödése a molekulában többféle kölcsönhatást eredményezhet. A hidrogénmolekulában az elektronok 2 atommaghoz való tartozása a potenciális energia csökkenését eredményezi. Az atommagok közeledésekor a rendszer potenciális energiája minimumot ér el. Ha az atommagok a kovalens kötéshossznál közelebb kerülnek egymáshoz, megnö a magok közötti taszítóerö, és a rendszer potenciális energiája is növekszik.
A kötési energia értékei a potenciális energia minimumának felelnek meg, és egy mólnyi adott típusú kovalens kötés képzödésekor szabadulnak fel. A többszörös kovalens kötéskor az atomok szorosabban kapcsolódnak, mivel megrövidül a kötéshossz, és nö a képzödéskor felszabaduló kötési energia. A 12. táblázat néhány kovalens kötés távolságát és energiáját mutatja.
Átmenet a kötéstípusok közt
A kovalens kötést alkotó közös elektronpár mindkét atomhoz tartozik. Az elektronsürüség eloszlása a két atommag eröterében a kétatomos molekulák esetében egyenletes (H2, Cl2, O2), ilyenkor apoláris vagy nem poláris kovalens kötésröl beszélünk. Amennyiben a kovalens kötés különbözö atomok közt jön létre, akkor az elektronsürüség már nem egyenletes, hanem az eltérö elektronegativitás miatt részlegesen pozitív (d ) és részlegesen negatív (d ) eloszlás alakul ki, mely a poláris kötés kialakulása következtében dipólusmolekula létrejöttét eredményezi.
Jellegzetes dipólusmolekulák a hidrogén-halogenidek (HF, HCl, HBr, HI) és a H2O. Ezek további külsö hatásra (elektrolitos disszociáció) ionos vegyületté alakulhatnak. Ekkor a pozitív és negatív töltések elkülönülnek, a kialakult kationok és anionok önálló egységként léteznek.
12. táblázat Néhány kovalens kötés távolsága és energiája
|
Kötéstípus |
Kötéshossz (nm) |
Kötési energia (kJ/mol) |
|
H H |
|
|
|
H Cl |
|
|
|
Cl Cl |
|
|
|
H C |
|
|
|
C C |
|
|
|
|
|
|
|
|
|
|
|
C O |
|
|
|
|
|
|
|
N N |
|
|
|
|
|
|
|
|
|
|
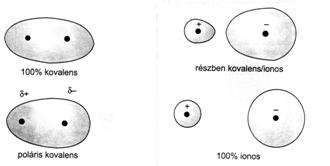
10. ábra A kovalens-ionos kötés átmenete
A tiszta 100%-os kovalens kötés ritka határeset, míg a tiszta 100 %-os ionos kötés legfeljebb az ideális ionkristályokban valósul meg. A közöttük levö átmenet folyamatos.
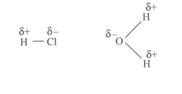
11. ábra: jellegzetes dipólusmolekulák.
A dipólusmolekulák külsö hatásra (pl. HCl-gáz oldása vízben) részben ionos vegyületté alakulhatnak át. Az ionkötésben a pozitív és negatív töltések elkülönültek, a kialakult kationok és anionok önálló egységként léteznek, ahogy ezt a 11. ábra mutatja.
A kovalens kötés elmélete
A kovalens kötés elméletei az elektronok molekulán belüli leírására vállalkoznak a hullámfüggvény eredményeinek felhasználásával. A kovalens kötés leírására két elmélet terjedt el, a vegyértékkötés- és a molekulaorbitál-elmélet. A vegyértékkötés-elmélet szerint az atomorbitálok eredeti jellegüket megtartva, a kialakuló kötés mentén egymásba hatolva átfedést hoznak létre. A molekulaorbitál-elmélet szerint az eredeti atomorbitálok megszünnek, és új elektronsürüség-eloszlású molekulaorbitál jelenik meg.
A vegyértékkötés-elmélet
A vegyértékkötés-elmélet szerint:
*a kovalens kötés az atomorbitálok átfedésével jön létre,
*többszörös kovalens kötések esetében a kötésszögek megfelelnek az atomorbitálok eredeti eloszlásának szögével,
*a kötés tengelye mentén egyszeres kötést alakít ki az elektronpár átfedése, a kialakuló szigmakötésben az atompályák átfedése a legnagyobb elektronsürüséget a két atom között hozza létre, ahol egyetlen s-(szigma)kötés alakulhat ki az s-s, s-p és a megfelelö irányítottságú p-p atomorbitálok átfedésével,
*kettös- vagy
hármaskötés 2 vagy 3 elektronpár kölcsönhatásaként jön létre; a létrejövö
p-(pi)kötések elektronsürüsége eltér a s-kötéstöl; a p-kötések
szimmetrikusan veszik körül a magokat összekötö tengelyt, és a
megfelelö irányítottságú p-p atomorbitálok átfedésével alakulnak ki a s-kötéssel rögzített atomok között,
*ha az atomorbitálok kombinálódnak, nagyobb átfedésü kötéseket létrehozó orbitálok jönnek létre és azonos számú, egyenértékü hibrid orbitálok keletkeznek.
Az egyes kialakuló kötéseket a 12. ábra mutatja, míg a 13. ábra. A vegyértékkötés-elmélet és molekulaorbitál-elmélet összehasonlítását reprezentálja.
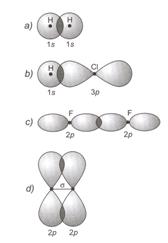
12. ábra. s-(szigma) és p-(pi)kötések kialakulása.
a) A hidrogénmolekula s-kötéseiben az 1s orbitálok kerülnek átfedésbe, elektronjaik párt képeznek. b) a hidrogén-klorid molekula s-kötését az 1s és 3p-atomorbitálok átfedése hozza létre. c) a fluormolekulában a 2p-orbitálok kötéstengely mentén kerülnek átfedésbe s-kötést létrehozva. d) a 2p orbitál átfedése, a már kialakult s-kötés " alatt és felett " p-kötést hoz létre.
Molekulaorbitál-elmélet
A molekulaorbitál-elmélet szerint:
*A molekulákban az elektronok módosult orbitálokon helyezkednek el, amelyek a molekula egészéhez tartoznak.
*Az atomorbitálok megfelelö kombinálásával a molekulaorbitálok burkolófelületei kiszámíthatók.
*Két különbözö atom egy-egy atomorbitálját kombinálva két molekulaorbitálhoz jutunk, melyek közül a kötö-molekulaorbitál energiája alacsonyabb, a lazító-molekulaorbitál energiája pedig magasabb lesz, mint az eredeti atomorbitálok energiaszintje.
*A molekulaorbitálok elektronokkal való feltöltési szabályai:
- az elektronok elöször a kisebb energiájú molekulaorbitálokat töltik fel (energiaminimumra való törekvés),
- egy molekulaorbitálon maximum két elektron tartózkodhat (Pauli-féle tilalmi elv),
- az azonos energiájú molekulaorbitálokat az elektronok egyenként párosítatlan spinnel töltik be (Hund-féle szabály).
A hidrogénmolekula felépítésénél a két hidrogénatommag a kovalens kötésnek megfelelö távolságban található, a molekulaorbitál az 1s-atompályák kombinációjából épül fel, tehát az alacsonyabb energiájú kötö-molekulaorbitálon helyezkedik el a két elektron, melynek következtében a hidrogénmolekula stabilabb mint a hidrogénatom.
A hipotetikus "He2" molekulában a négy elektron a kötö- és a lazító-molekulaorbitálokat is betölti, ezért a "He2" molekula képzödése nem stabilizálná a hélium atomokat, ezért nem is jön létre.
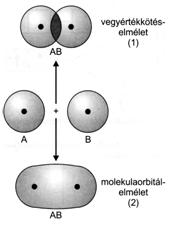
13. ábra. A vegyértékkötés-elmélet és molekulaorbitál-elmélet összehasonlítása
Hibridorbitálok
A többatomos molekulák kovalens kötés szerkezetét és geometriáját az eredeti atomorbitálok átfedésével már nem tudja leírni a vegyértékkötés elmélet, ezért bevezették az atomorbitálok hibridizációját. Az így kialakult hibridorbitálok átfedési képessége (a kötés erössége) nagyobb, mint az eredeti atomorbitáloké és irányuk megfelel a molekulában mért kötésszögeknek. A hibridorbitálok kialakulását a BeCl2 példáján mutatjuk be. A molekula gázfázisban lineáris szerkezetü: Cl-Be-Cl. A Be atom külsö elekronkonfigurációja (2s2) már párosított elektronokat jelöl. Ez a két alapállapotú elektron a hibridizáció során az eredeti atomorbitáloknál magasabb energiaszintü hibridorbitálokra kerül. A hibridizációhoz szükséges többletenergiát böven fedezi a nagyobb átfedésü ("erösebb") kovalens kötések képzödésénél felszabaduló energia. A két hibridorbitál kialakításában s- és p-atomorbitálok vesznek részt, ezért sp-hibridorbitálok jönnek létre.
Az sp-hibridorbitálok lineáris szerkezetüek, így a BeCl2 molekuában a kötésszög 180 °. A két s-kötés az atomok elektronnegativitás-különbsége miatt poláris, de a molekula aszimmetrikus következtében a BeCl2-nak nincs dipolusmomentuma ( nem dipólusmolekula)
A bór kovalens kötésü vegyületeiben sp2-hibridorbitálokat alakít ki. A BCl3 molekulában a három sp2-hibridorbitál szimmetrikus elrendezésü és siktrigonális szerkezetet alakít ki. A szén egyik legjellemzöbb kovalens kötéses szerkezetében különbözö hibridorbitálok kialakítása lehetséges, amelyet a 14. ábra mutat.
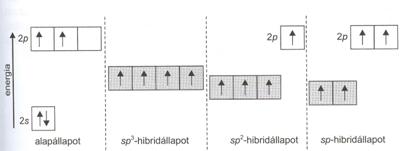
14. ábra. A szén lehetséges hibridállapotai
A szén atom esetében három lehetséges hibridállapot van. Ezeknél az sp3 -hibrid esetében egy tetraéderes elrendezödés alakul ki. A hibridpályák poláris s-kötéseket hoznak létre, de a szimmetrikus elhelyezkedés miatt nem dipólusmolekula. A különbözö molekulák szerkezetét a vegyértékkötés elmélet alapján a 15.ábra mutatja, amelyen látható, hogy a centrális atomok hibridorbitáljai a Cl-atomok p-orbitáljaival s-kötést alakítanak ki.
A hibridpályák kialakításában a d-atomorbitálok is részt vehetnek, ezáltal akár hat kovalens kötés kialakítása is lehetséges, az sp3d2 -hibridorbitál található a réz(II)-komplexekben. Több atomos molekulák között vannak olyanok, amelyekben a központi atom hibridpályáinak kialakításában a nem kötö elektronpárok is részt vesznek.
A metánmolekulában a C-atom négy kötö hibridorbitált alkot, ezért tetraéderes szerkezet alakul ki. (Ilyen típusú kötések vannak a telített szénvegyületekben.) Az ammónia molekulában a N-atom három hibridorbitállal és egy nem kötö elektronpárral rendelkezik. A nemkötö elektronpár közelebb van a N-atomhoz és ezért taszító hatást fejt ki a három kötö hibridorbitálra. Az ammónia molekula torzul, trigonális piramis szerkezet alakul ki, kb. 107°-os kötésszöggel, amely a 16. ábrán látható. A datív kötést tartalmazó ammóniumionban (NH4)+ ismét tetraéderes lesz a szerkezet a szimmetria miatt. A víz molekulában már kér nem kötö elektronpár található, a taszító hatások miatt a tetraéderes kötésszög tovább csökken 104,5°-ra. A sósav molekulában a klóratom körül három nemkötö és egy kötö hibridorbitál található. A kétatomos HCl-molekula lineáris szerkezetü, közel tetraéderes elrendezödéssel a Cl-atom körül.
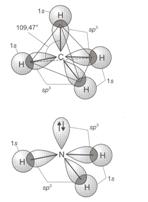
15. ábra. Metán és ammónia molekulák szerkezete.
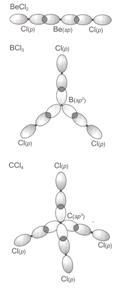
16. ábra. BeCl2-, BCl3- és CCl4- molekulák szerkezete a vegyértékkötés alapján.
Többszörös kovalens kötések
A vegyértékkötés-elmélet lapján s-kötés minden kialakuló elsö kötés, a többszörös kovalens kötéseket a további kötések p-kötések biztosítják. Ilyen p-kötések találhatók az etén és acetilén molekulákban:
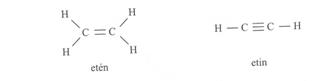
A kettös kötésü (s és p) eténmolekulában a szénatomok sp2 hibridizációjuak, egy p elektron megtartotta eredeti állapotát. A három sp2 hibridorbitál síktrigonális elrendezödésü, és a kötésszög 120°. Ezek alakítják ki az etén molekula s-kötéseit (s-vázát), a C-C és C-H kötéseket létrehozva.. A C-C -kötés szabad rotációját, elfordulását a két p-elektron alkotta p-kötés akadályozza meg, rögzítve a molekula térszerkezetét. Ezt mutatja a 17. ábra.
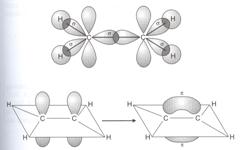
17. ábra: Az eténmolekula s-váza és p-kötés kialakulása
A hármas kötésü (s és 2p) etinmolekulában a szénatomok lineáris geometriát biztosító sp-hibridállapotban vannak, ezért a két p-elektron megtartotta eredeti állapotát. Az etinmolekula H-C-C-H atomjai egy egyenes mentén helyezkednek el (s-kötések) és a két p-kötés mintegy körbeveszi a C-C egyszeres kovalens kötést, amely a 19. ábrán látható.
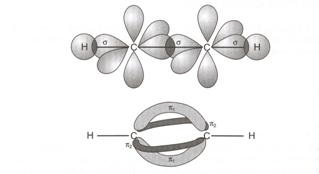
19. ábra. Az etinmolekula s-váza és 2p-kötés kialakulása
A rezonancia és a p-kötés delokalizációja
Számos olyan eset van, amikor a molekula vagy összetett ion kovalens kötései nem írhatók le egyszerüen a vegyértékkötés-elmélettel.
Például a karbonát ionban a centrális C atom sp2 hibridizációjú, így a három O atom síktrigonális elrendezödésü. A három s-kötés mellett kialakul egy p kötés is valamelyik O és C atom között, azonban ez nem rögzíthetö egyetlen O atomhoz, hanem un. rezonanciahibrid lép fel és egy határszerkezet jön létre: 1s-kötést és kb. 1/3 p kötést jelent, a karbonátionban tehát a p kötés helyzete nem rögzített:
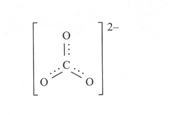
Hasonló jelenség található a többi összetett ionokban (SO42-, PO43-, NO3-) és a szerves molekulákban, például a benzol és butadién esetében. A benzol szerkezetében három p kötés is egyenletesen terjed ki az egész molekulára, delokalizálódik, amely a 20. ábrán látható.
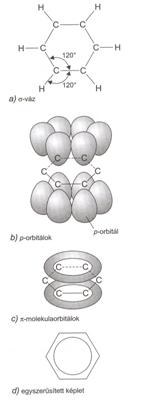
20. ábra. Benzolmolekula szerkezete
A benzolmolekula síkbeli, hatszöges szerkezet, amelyben a szénatomok sp2-hibridpályákkal kapcsolódnak a szomszédos szénatomokhoz és egy hidrogénatomhoz, kialakítva a s-vázat (20.a ábra): A szénatomok p-orbitáljai merölegesek erre a síkra (20.b ábra). A hat p-orbitálból p molekulaorbitálok alakulnak ki, amelyek delokalizálódnak (20.c). Valójában a C-C kötés rendje 1s és ˝ p kötésnek felel meg. Ezt igazolja a C-C kötés távolsága és energiája, amely átmenetet képez az egyszeres és kettöskötés között. A benzol egyszerüsített képletét a 20.d ábra mutatja.
Másodlagos kémiai kötések
A molekulák között ható vonzóerök alakítják ki az anyagok gáz, folyadék vagy szilárd halmazállapotát. A molekulák közötti erök nagysága hatással van olyan fizikai mennyiségekre, mint pl. olvadáspont, forráspont.
A másodlagos kémiai kötéseknek 3 alaptípusát ismerjük:
*leggyengébbek a London-féle erök,
*erösebb a kölcsönhatás a dipólusmolekulák között,
*legerösebb intermolekuláris kapcsolat a hidrogénkötés.
Az elsö két másodlagos kémiai kötés esetében a kölcsönhatás energiája 0,1-10 kJ/mol, a hidrogénkötésnél 10-50 kJ/mol. E kötöerök lényegesen kisebbek az ionos vagy kovalens kötések kötési energiájánál, melyek a 100 kJ/mol nagyságrendbe esnek.
A London-féle erök
Az egyatomos nemesgázok cseppfolyósíthatósága arra utal, hogy az apoláris atomok vagy molekulák között is kialakulhat vonzóerö a molekulák pillanatnyi polarizációja miatt. A polarizációt az elektronfelhö mag körüli rezgései alakítják ki. A 10Ne-atomban 10 elektron helyezkedik el az n=1 és n=2 fökvantumszámú héjakon. Egy idöpillanatban az elektronfelhö szimmetrikus töltéseloszlása torzulhat, és egy kis elektromos momentum keletkezik. Ez hasonló momentumot indukál a hozzá közel esö neonatomban, melynek következtében gyenge vonzás lép fel. Az apoláris molekulák között kialakuló gyenge vonzás annál nagyobb, minél nagyobb az egy molekulára jutó elektronok száma. Így pl. nemesgázoknál a forráspont lineárisan változik az elektronszámmal: az argon forráspontja -186oC, kriptoné -153oC, xenoné -108oC.
A London-féle (másik szokásos elnevezés van der Waals-féle) eröknek nevezett gyenge intermolekuláris kölcsönhatások nagysága a molekula alakjától és a burkoló elektronfelhötöl is függ. Így pl. a nyújtott szénláncú n-pentán molekulák kölcsönhatási felülete lényegesen nagyobb, mint a neopentán esetében. A n-pentánnál többszörös molekula asszociátumok alakulnak ki párhuzamos illeszkedéssel, melynek következtében a n-pentán forráspontja 36,2 oC. A gömbszerü neopentán kölcsönhatása a kisebb felület miatt lényegesen csökken, ezért a forráspont is lényegesen alacsonyabb (9,5 oC)
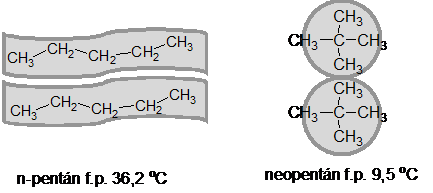
21. ábra. A molekula alak hatása a London-féle erökre
A London-féle erök fellépnek tetszés szerinti molekulák között is. Térben nem irányítottak, a vonzóerök már a molekulák van der Waals sugarának (0,4-0,6 mm) megfelelö távolságban kialakulnak. Hatásukat azonban a velük egyidejüleg ható egyéb, erösebb intermolekuláris kölcsönhatások gyakran elnyomják.
Dipólus-dipólus kölcsönhatások
Megfelelö molekulageometria esetén a poláris kovalens kötés kialakulása dipólusmolekula létrejöttét eredményezi. A molekula poláris jellegét a dipólusmomentummal jellemezhetjük, melynek jelölése m (mü), egysége: debye (D).
A víz dipólusmomentuma m = 1,84 D, az ammóniáé m = 1,47 D, a kloroformé m = 1,01 D, a széntetrakloridé és a széndioxidé m = 0 D.
A dipólusmomentum értékeiböl látható, hogy a molekula szerkezete határozza meg a dipólus- (H2O, NH3, CHCl3) vagy apoláris (CO2, CCl4) jelleget.
A dipólusmolekulák kölcsönhatása folyékony vagy szilárd halmazállapotban rendezett szerkezetet alakíthat ki. A dipólusmolekulák rendezettségére jellemzö a lineáris szerkezet, de a szomszédos láncok is kölcsönhatásba kerülhetnek egymással. A dipólus-dipólus kölcsönhatások irányítottak, mely a molekulák szorosabb kapcsolatát is jelenti a London-féle erökhöz képest.
A dipólusmolekulák kölcsönhatása folyékony vagy szilárd halmazállapotban rendezett szerkezetet alakíthat ki. A dipólusmolekulák rendezettségére jellemzö a lineáris szerkezet, de a szomszédos láncok is kölcsönhatásba kerülhetnek egymással. A dipólus-dipólus kölcsönhatások irányítottak, mely a molekulák szorosabb kapcsolatát is jelenti a London-féle erökhöz képest. A poláros kötésü molekulák szerkezetét a 22. ábra mutatja.
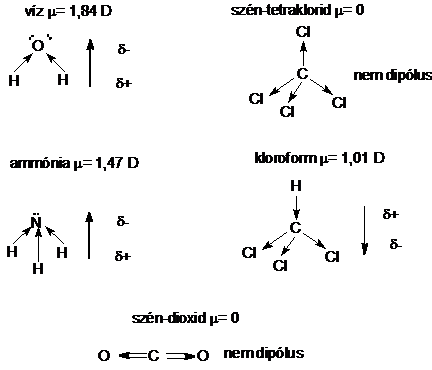
22.ábra . A poláris kovalens kötésü molekulák szerkezete
A hidrogénkötés
A hidrogénkötés a legerösebb intermolekuláris kölcsönhatás. Amikor a hidrogénatom egy kisméretü és nagy elektronegativitású atomhoz (oxigén, nitrogén, fluor) kovalens kötéssel kapcsolódik, a keletkezö molekula nagymértékben poláris. Az ilyen hidrogénatom részleges pozitív töltéssel bír, és kölcsönhatásra képes a szomszédos molekula elektronegatív atomjának nemkötö elektronpárjával. A H-F molekulák között fellépö hidrogénkötés a legerösebb, mivel a fluor a legelektronegatívabb:
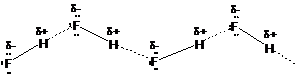
A hidrogénkötés jelentös hatással van a forráspontra is. A dipólus nélküli molekulák forráspontja a CH4-töl az SnH4-ig a London-féle intermolekuláris erök miatt folyamatosan növekszik. A molekulák közti hidrogénkötés miatt a nitrogén, az oxigén és a fluor vegyületei rendkívül magas forráspontjukkal tünnek ki. A hidrogénkötésnek igen fontos szerepe van az alkoholok, karbonsavak stb. tulajdonságainak kialakításában, ill. alapvetöen meghatározza a fehérjék és nukleinsavak térszerkezetét.
A szerves és biokémiában elöforduló leggyakoribb hidrogénkötések távolsága 0,263-0,310 nm között változik, mely intermolekuláris kötéstávolságok kb. kétszeresei a kovalens kötéshosszaknak. A hidrogénkötés térben irányított; akkor a legerösebb, ha az elektronegatív atom lineárisan helyezkedik el. Ilyen lineáris hidrogénkötés alakítja ki a fehérjék a-hélixét.
Találat: 11776