| kategória | ||||||||||
|
|
||||||||||
|
|
||
ELEKTROKÉMIA
Az elektrokémia a kémiai reakciók által elöidézett elektromos jelenségekkel, és az elektromos áram hatására bekövetkezö kémiai változásokkal foglalkozik.
Redoxifolyamatok
Az oxidációs-redukciós vagy más néven redoxireakciók a legfontosabb kémiai reakciók közé tartoznak. Ilyen reakciók például a fosszilis tüzelöanyagok elégetése, az elektromos áram tárolása akkumulátorokban, de ilyen pl. az energiatermelés vagy -felhasználás érdekében lejátszódó kémiai reakciók legtöbbje az élö szervezetben, vagy a tápanyagok felhasználása a sejtekben. A redoxireakciók közös ismertetöjele, hogy elektronfelvétellel és elektronleadással járnak, melynek során megváltozik a részvevö kémiai elemek oxidációs száma.
Oxidáció és redukció
Ha elvégezzük azt a klasszikus kísérletet, melynek során a réz(II)-szulfátot tartalmazó oldatba cinklemezt helyezünk, akkor a cink lassan feloldódik, és az oldatból fémréz válik ki. Ennek során a Cu2+-tartalmú vizes oldatra jellemzö kék szín eltünik:
Zn(s) + CuSO4(aq) Cu(s) + ZnSO4(aq).
Az ionegyenletböl a folyamat lényege jobban kitünik:
Zn(s) + Cu2+ Cu(s) + Zn2+.
A fenti redoxifolyamat két részreakcióra bontható fel:
Zn(s) Zn2+ + 2 e- (oxidáció),
Cu2+ + 2 e- Cu(s) (redukció).
Az elvégzett kísérlet tanulságait általánosítva a redoxireakciókra az alábbi megállapításokat tehetjük:
*az oxidáció és a redukció mindig együtt játszódik le, tehát az oxidációs folyamatokat mindig kíséri a redukció is, és így a redukcióval egyidöben mindig oxidáció is végbemegy,
*a redoxireakciókban végbemenö elektronátmenet során mindig megváltozik a részecskék töltése.
A töltésváltozás tulajdonképpen elektronok leadása vagy felvétele.
Oxidáció minden olyan reakció, amelyben egy atom, ion vagy molekula elektront ad le, redukció pedig az, amikor elektront vesz fel. Az elektront leadó anyagokat elektrondonoroknak, az elektront felvevö anyagokat elektronakceptoroknak nevezzük. Az elektrondonor a redoxireakciókban oxidálódik, ezért redukálószer, az elektronakceptor a redoxifolyamatokban redukálódik, ezért oxidálószer. A redukáló vagy oxidálóképesség a reakciópartnertöl is függ, tehát ilyen értelemben viszonylagos.
Az oxidációs szám
Az oxidációs szám az atomok oxidációs állapotának jellemzésére alkalmas elöjeles egész szám amely megadja, hogy valamely atom az adott vegyületbe jutás során hány elektront adott le (pozitív elöjel, oxidáció), vagy vett fel (negatív elöjel, redukció) akár teljes mértékben (ionképzödés), akár részlegesen (poláris kovalens kötés). Az oxidációs szám számolásához az alábbiakat kell figyelembe venni:
* Az elemek oxidációs száma mindig 0, függetlenül attól, hogy a molekulát hány atom építi fel (O2, P4, S8, H2, Cl2, Ar).
*Egyszerü
vagy egyatomos ionok oxidációs száma azonos az ion töltésével, az alumíniumion
(Al3+) oxidációs száma +
*Az oxigén
oxidációs állapota vegyületeiben -2, kivéve a peroxidokban, ahol
* A molekulán belül az egyes atomok oxidációs számának algebrai összege egyenlö a molekula töltésével.
Elöl mindig a + és hátul a negatív oxidációs számú alkotorész szerepel. A fém halogenidekben a halogén mindig -1, az összetett ionban az összetett ion töltése azonos a savmaradék töltésével (pl. SO42- ).
Így pl. a nátrium-kloridban az oxidációs számok összege 0, míg a szulfátionban -2:
NaCl ![]()
+1 -1 +6 -2
[+1 + (-1)] = 0 [+6 + 4(-2)] = -2
Azt, hogy egy atom oxidációs száma negatív vagy pozitív elöjelü, 818c28i az elektronegativitás különbség határozza meg. A elektronegatívabb atom oxidációs száma lesz a negatív, és a kevésbé negatívabbé a pozitív. Az ammónia esetében pl. a nitrogén oxidációs száma -3, mivel elektronegativitása nagyobb, mint a hidrogéné. A nitrogén-fluorid (NF3) esetében viszont a nitrogén oxidációs száma +3, mivel a fluor az elektronegatívabb atom. A fluor oxidációs száma mindig -1, mivel elektronegativitása az elemek között a legnagyobb:
NH3 NF3
-3 +1 +3 -1
[-3 + 3(+1)] = 0 [+3 + 3(-1)] = 0
Egy
elem oxidációs száma változhat attól függöen, hogy milyen vegyületet
alkot. A mangán oxidációs száma a mangán-kloridban +
MnCl2 MnO2 KMnO4
+2 -1 +4 -2 +1 +7 -2
Az oxidációs számot alkalmazva a redoxireakciókra megállapíthatjuk, hogy az oxidációs szám értéke oxidációban nö, redukcióban pedig csökken. A cink- és a réz(II)-ionok reakciójában a cink oxidációs száma 0-ról +2-re nö, tehát oxidálódik, a réz(II)-ionok oxidációs száma +2-röl 0-ra csökken, tehát redukálódik:
Zn(s) + Cu+2 Cu(s) + Zn+2
0 +2 0 +2
A vegyületekben lévö atomok
maximális oxidációs száma az esetek többségében megegyezik az elem periódusos
rendszerbeli oszlopának számával. A szén maximális oxidációs száma +
Egy redoxifolyamatban diszproporcionálódás következik be akkor, ha az adott oxidációs számú elem atomjainak egyik része oxidálódik, a másik része pedig redukálódik. A nulla oxidációs számú klór vízzel reagálva részben -1, részben +1 oxidációs számúvá (HCl ill. HOCl) válik.
Cl2 + H2O HCl + HOCl
Színproporcionálódás során valamely elem két különbözö fokú oxidációs számú atomjai egyenlö oxidációs számúvá válnak. Ez következik be akkor, amikor a jodátionok (+5 oxidációs számú jód) reakciója a jodidionokkal (-1 oxidációs számú jód) elemi jódot (0 oxidációs szám) eredményez.
IO![]() + 5 I + 6 H+
3 J2 + 3 H2O
+ 5 I + 6 H+
3 J2 + 3 H2O
Redoxirendszerek
A redoxireakciókban ionok és elemek is részt vehetnek. A szén oxidációja során ( C(s) + O2(g) = CO2(g) ) a szén oxidálódik, az oxigén redukálódik. Az oxidációs-redukciós reakciókat általános alakban felírva az alábbi egyenletet kapjuk:
![]() oxidált alak + ne- redukált alakne- ,
oxidált alak + ne- redukált alakne- ,
(oxidálószer) (redukálószer)
amely egyesíti az oxidációs-redukciós folyamatokat. Ismerve a reakciókban részvevö anyagok tulajdonságait, a reakció végtermékét elöre meg tudjuk mondani.
A redoxireakció, azaz az elektronátadás irányát meg lehet állapítani a reakció szabadentalpia-változásából ill. az elektródpotenciálból.
Az elektrokémia alapjai
Az elektrokémia legegyszerübb jelensége az elektromosság vezetése folyadék és szilárd halmazállapotban. A fémek (elsöfajú vezetök) a delokalizált elektronok segítségével vezetik az elektromos áramot, az ionvezetök (másodfajú vezetök) pozitív és negatív töltésü ionok segítségével vezetik az elektromos áramot, és a vezetésben mindkét ion részt vesz. Az ionvezetök sók és bázisok olvadékai, oldatai, valamint savak oldatai. Az elektromosság sem a fémek, sem az ionvezetök esetében nem jár kémiai változással. Az elektródokon azonban kémiai változás következik be, ahol az elektrolit fémvezetövel érintkezik.
Elektromos áram és kémiai reakció kölcsönhatása kettös:
* galvánelem - kémia reakció elektromos áramot termel
* elektrolízis - elektromos áram kémiai változást idéz elö.
Elektródpotenciál
Ha egy fém olyan oldatba merül, amelyben a saját ionjainak szabadentalpiája kisebb, mint a fémben, akkor a fémböl ionok mennek az oldatba, feltéve, ha van a környezetben megfelelö reakciópartner, amely a fém által leadott elektront felveszi. Amennyiben a fémnek (Zn) nincs megfelelö reakciópartnere (Cu2+), akkor a folyamat csak igen kismértékben megy végbe, mert a fém (Zn) felületén visszamaradt elektronok vonzani fogják az oldatba igyekvö fémionokat (Zn2+), és így megakadályozzák a további oxidációt.
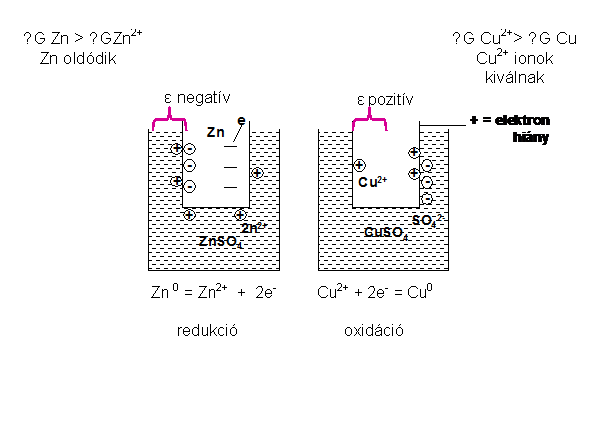 65.ábra. Elektromos kettös réteg kialakulása fém és
oldat között
65.ábra. Elektromos kettös réteg kialakulása fém és
oldat között
Ebben az esetben a fém töltése az oldathoz képest negatív lesz. A fém és az oldat között elektromos feszültség, potenciálkülönbség alakul ki valamint egy elektromos kettös réteg, amely akadályozza a fém további oldódását illetve kiválását. A bármely fémIfémion fázishatárán kialakuló feszültséget ill. más néven potenciálkülönbséget az illetö fémIfémion elektródpotenciáljának hívjuk. Az elektródpotenciál nagysága az adott hömérsékleten függ a fém fajtájától és az oldat koncentrációjától:
RT zF
![]() ε = ε 0 + log cion illetve tízes alapú logaritmus esetében
ε = ε 0 + log cion illetve tízes alapú logaritmus esetében
RT zF
![]() ε = ε 0 +
2,303 lg cion
, ahol
ε = ε 0 +
2,303 lg cion
, ahol
R-egyetemes gázállandó, T = hömérséklet, z- ion vegyértéke, cion konc (mol/dm3), = elektródpotenciál, o=normálpotenciál (c=1 mol/dm3).
Az elektródpotenciál abszolút értéke nem mérhetö meg, csak a két elektródból álló galvánelem elektromotoros ereje.
Galvánelemek
Amikor cinklemezt merítünk réz(II)-ionok oldatába, a cinklemezen réz válik ki, a Cu2+ közvetlenül a cinktöl veszi át az elektronokat, miközben a cink Zn2+-ok formájában oldatba megy. A folyamat szabadentalpia csökkenéssel jár, mivel önként lejátszódik. Ez az elektronátmenet felhasználható elektromos energiatermelésre, ha az oxidációt és a redukciót sikerül térbelileg elválasztani egymástól. Az cink-réz galvánelem celláiban a cink oxidációja és a réz(II)-ion redukciója egymástól elkülönül. A cinklemez saját ionját tartalmazó sóoldatba (ZnSO4) merül, a réz(II)-iont tartalmazó oldatba (CuSO4) pedig rézlemez merül. Ezek a galvánelem két elektródja. Ha a két elektródot fémes vezetövel összekötjük, és a két elektródfolyadék között közvetlenül is galvanikus kapcsolatot létesítünk (KCl-os sóhíd), i > 0 intenzitású áram indul meg a rendszerben. Az ezt kiváltó elektródfolyamatok a következök:
Zn(s) = Zn2+ + 2 e- (oxidáció az anódon),
Cu2+ + 2 e- = Cu(s) (redukció a katódon).
Az így müködö galvánelem elektródjai közti potenciálkülönbség (kapocsfeszültség) a kémiai folyamat elörehaladtával folyamatosan csökken, miközben kémiai energia átalakul elektromos energiává. Ez a folyamat megszünik, amikor a rendszer termodinamikai egyensúlyba kerül, vagyis amikor az áramintenzitás nullává válik. Az ebben az esetben mérhetö kapocsfeszültséget - vagyis az egyensúlyi elektródpotenciálok különbségét - elektromotoros erönek nevezzük.
Az elözöekben tárgyalt galvánelemet Daniell-féle elemnek is szokták nevezni.


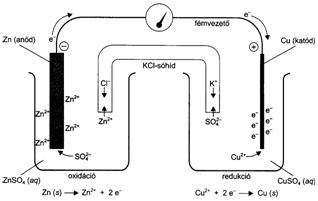
66. ábra Daniell galván elem felépítése
A galvánelem elektromotoros ereje (Eel) a katód és az anódpotenciál különbségeként (De) is megadható:
Eel = De ered, katód eox, anód
(A galván elem anódja mindig az elektronegatívabb komponens, ahol az oxidáció van, katódja a pozitívabb potenciálú elem, ahol a reakció mindig redukció )
Elektródok
Fémelektródok (elsöfajú elektródok)
A galvánelemben a redoxirendszereket képviselö cellákat hívjuk elektródoknak. A galvánelemek leírására gyakran alkalmazzák a rövidített jelöléseket, melynek során a részvevö anyagokat képlettel, a fázishatárt függöleges vonallal, míg a sóhidat kettös függöleges vonallal jelölik. Baloldalon jelölik az anódot (oxidáció), jobboldalon pedig a katódot (redukció). A jelölésnél utalnak a koncentrációra, gázok esetében a gáz nyomására:
anód I anód elektrolit II katód elektrolit I katód
Zn(s) = Zn2+ + 2 e- Cu2+ + 2 e- = Cu(s)
Az elektródok legegyszerübb típusai a fémelektródok, amelyeknél a fém saját ionjait tartalmazó sóoldatba merül. Ilyen pl. a cink - cink-szulfát elektród,
Zn I Zn2+,
Az elektródon lejátszódó félcella reakció reverzíbilis, azaz az oxidáció és a redukció egyaránt lejátszódhat attól függöen, hogy miböl áll a galvánelem másik elektródja:
![]() Zn(s) Zn2+ +
2 e
Zn(s) Zn2+ +
2 e
Az elektródpotenciálok abszolút értékei nem mérhetök, azok különbségei azonban, megfelelö galvánelem létrehozása esetén igen. A galvánelem elektromotoros ereje (Eel) a katód és az anódpotenciál különbségeként (De) is megadható:
Eel = De ered, katód eox, anód
Mindig csak a két elektród közötti potenciálkülönbség mérhetö, ezért az elektródpotenciál összehasonlító (relatív) értékének meghatározására vonatkoztatási alapra, standard elektródra van szükség. Elektródpotenciál alatt éppen ezért az adott elektródból és egy vonatkoztatási pontnak elfogadott elektródból álló galvánelem elektromotoros erejét értjük.
A cink-réz galvánelem redoxireakciója és potenciálkülönbsége a 37. táblázat segítségével közvetlenül számítható, amennyiben a galvánelemhez standardállapotú elektródokat használunk:
Zn2+ + 2 e = Zn
(s) e![]() = -0,763 V (redukció),
= -0,763 V (redukció),
Cu2+
+ 2 e = Cu (s) e![]() = 0,337 V (redukció).
= 0,337 V (redukció).
A galvánelemben a negatívabb
standard-elektródpotenciálú termék oxidálódik, ezért e![]() elöjele pozitív:
elöjele pozitív:
Zn(s) =
Zn2+ + 2 e e![]() = 0,763 V (oxidáció)
= 0,763 V (oxidáció)
Cu2+
+ 2 e = Cu(s) e![]() = 0,337 V (redukció)
= 0,337 V (redukció)
Zn(s) + Cu2+ = Zn2+ + Cu (s) De e![]() + e
+ e![]() = 0,763 V + 0,337 V = 1,100 V
= 0,763 V + 0,337 V = 1,100 V
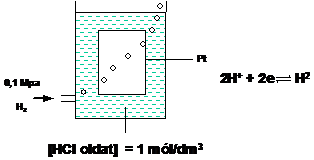
Gázelektródok (hidrogénelektród)
Gázelektródok elvi szempontból csak abban különböznek a fémelektródoktól, hogy bennük az elemi állapotú anyag nem szilárd, hanem gáz halmazállapotú. Ez utóbbi átbuborékol a neki megfelelö ionokat tartalmazó folyadékon. Pl. hidrogén elektród esetén hidrogén gázt vezetünk keresztül sósav oldaton. A gázelektródoknak gyakorlati szempontból fontos része egy indifferens anyagból (Pt, Au. stb.) készült ún. vezetö elektród is, melynek felületén az elektronátadás lejátszódik. Így végsö soron potenciálkülönbség (elektródpotenciál) alakul ki az indifferens fém és az oldat között. A lehetséges gázelektródok közül elvi szempontból a hidrogénelektródnak, pontosabban a standard hidrogénelektródnak van kitüntetett szerepe.
A hidrogénelektód tartozékaként szereplö platina-elektród annyiban nem indifferens, hogy rajta a molekuláris hidrogén adszorbeálódik, ezzel összefüggésben heterogén katalízis lép fel, s a hidrogén atomos állapotúvá válik:
Ennek azért van nagy jelentösége, mert csak a hidrogén atomok képesek elektronleadásra, a hidrogén molekulák nem. Miután a hidrogén ily módon elektrokémiailag aktív állapotba jutott, sor kerül a tulajdonképpeni elektródfolyamatra:
![]()
CH+ √ pH2
![]() eH eOH + 2,303 lg
eH eOH + 2,303 lg
[H+] = [H+] mól/dm3
pH2 = H2 parciális nyomása
A hidrogénelektód rövid jelölése (celladiagramja) 0,1 MPa nyomású hidrogénre és az 1 mol/dm3 hidrogéniont tartalmazó oldatra a következö:
(Pt)H2
(g; 0,1MPa) I H+ (
ha c = 1, mol/dm3 és pH2=0,1MPa
akkor eH eOH
eH eOH megállapodásszerüen 0,00
Fémek standard potenciáljának a meghatározása:
Az elektródpotenciál, illetve standardpotenciál meghatározásához most már csak össze kell állítani a kérdéses elektród, és a standard hidrogénelektródból álló galvánelemet, és meg kell mérni annak elektromotoros erejét, amely egyenlö lesz az adott elektród elektródpotenciáljával.
A vonatkoztatási alap, nemzetközi
megállapodás szerint, a standard hidrogénelektród, melyhez az összes többi
elektród potenciálját viszonyítjuk. A standard hidrogénelektród esetében 0,1
MPa nyomású hidrogéngáz buborékol át 25 oC-os
Standard elektródpotenciálja definíciószerüen 0,00 eo = 0,00 V. A standard hidrogénelektródon végbemenö reakció az alábbi:
2 H+ (
A 37. táblázatban a leggyakrabban használatos standard redukciós elektródpotenciálokat soroltuk fel 25 oC-on. Az elektródreakciók (vagy félcella-reakciók) pozitív elöjele azt mutatja, hogy ezeken az elektródokon redukció játszódik le, ha a standard hidrogénelektróddal galvánelemet alkotnak. A potenciálkülönbség a táblázatból egyszerüen számítható. Így pl. a Cu I Cu2+ elektródból és a standard hidrogénelektródból álló galvánelem elektromos ereje 0,337 V.
(Pt) I H2 (g; 0,1
MPa) I H+ (
A két félcella-reakcióból megállapítható, hogy a standard rézelektród redukálódik, ezért elektródpotenciálja eo = 0,337 V.
H2(g) = 2 H+ + 2 e (oxidáció),
Cu2+ + 2 e = Cu(s) (redukció).
A standard hidrogénelektródból és a standard cinkelektródból álló galvánelem celladiagramja:
Zn I Zn2+ (
Az önként végbemenö reakciókban a cink oxidálódik, ezért a standard redukciós potenciál negatív elöjelü, -0,763 V.
Zn(s) = Zn2+ + 2 e (oxidáció),
2 H+ + 2 e = H2(g) (redukció).
A negatív elöjel arra utal, hogy ezeken az elektródokon nem játszódik le spontán redukció, ha a hidrogénelektróddal galvánelemet alkotnak.
A 34. táblázat reakcióegyenletei oxidált reaktánsokat és azok redukált formáit tartalmazza. A legnegatívabb elektródpotenciálú reaktánsok (Li+, Ba2+, Na+, Zn2+) nagyon gyenge oxidálószerek, ugyanakkor termékeik (Li, Ba, Na, Zn) igen erös redukálószerek. Pozitív elektródpotenciálú reaktánsok (Ag+, Pd2+, Cl2, F2) a legerösebb oxidálószerek, míg ezek termékei (Ag, Pd, Cl , F ) a leggyengébb redukálószerek. Két elektródreakció összekapcsolásával létrejött galvánelemben a spontán redoxireakció iránya is megállapítható. A két redukálószer közül a negatívabb standard elektródpotenciálú termék oxidálódik, a pozitívabb vagy kevésbé negatív standard elektródpotenciálú reaktáns redukálódik
34. táblázat. Standard redukciós elektródpotenciálok 25 oC-on
|
Elektródfolyamat (redukció) |
eo(volt) |
|
Li+ + e Li (s) |
|
|
K+ + e K (s) |
|
|
Ba2+ + 2 e Ba (s) |
|
|
Ca2+ + 2 e Ca (s) |
|
|
Na+ + e Na (s) |
|
|
Mg2+ + 2 e Mg (s) |
|
|
Al3+ + 3 e Al (s) |
|
|
Zn2+ + 2 e Zn (s) |
|
|
Cr3+ + 3 e Cr (s) |
|
|
Fe2+ + 2 e Fe (s) |
|
|
Cr3+ + e Cr2+ |
|
|
Ni2+ + 2 e Ni (s) |
|
|
Pb2+ + 2 e Pb (s) |
|
|
2 H+ + 2 e H2 (g) |
|
|
Cu2+ + e Cu+ |
|
|
AgCl(s) + e Ag (s) + Cl |
|
|
Cu2+ + 2 e Cu (s) |
|
|
I2 (s) + 2 e 2 I |
|
|
Fe3+ + e Fe2+ |
|
|
Hg |
|
|
Ag+ + e Ag (s) |
|
|
Pd2+ + 2 e Pd (s) |
|
|
Br2 (l) + 2 e 2 Br |
|
|
Br2 (aq) + 2 e 2 Br |
|
|
˝ O2 (g) + 2 H+ + 2 e H2O (l) |
|
|
Cr2O |
|
|
Cl2 (g) + 2 e 2 Cl |
|
|
Au3+ + 3 e Au (s) |
|
|
MnO |
|
|
F2 (g)
+ 2 e |
|
Az elsöfajú elektródok: fém I fémion+ és H2 I H+ gázelektród esetében a koncentráció változását követi a potenciál változását. Az elsöfajú elektródokban a koncentrációmüködés közben állandóan változik, ezért a potenciáljuk is folyamatosan változik. Elsöfajú elektródok a fém, a gáz és a redoxielektródok ( lásd késöbb)
Fémcsapadék elektródok ( másodfajú elektródok)
A másodfajú elektródok állnak:
fém fém nehezen oldódó sója fém jól oldódó sója, ahol az anion közös
*Ag AgCl KCl az anion koncentrációjától függöen
telített ;
Müködésük eltér a megfelelö fémelektródétól. Az ezüst-ezüst-klorid esetében pl.
(Ag I
AgCl(s) I Cl- (
![]() AgCl(s) + e- Ag(s) + Cl
AgCl(s) + e- Ag(s) + Cl
Ag AgCl KCl elektród müködése: azonos mechanizmus szerint játszódik le, de a potenciált nemcsak a fém oxidációja vagy redukciója befolyásolja
* ha az elektród anódként van kapcsolva
az anódfolyamat Ag0 - 1e = Ag+
de a rendszerben van AgCl csapadék, amelyre igaz az oldhatósági szorzat
![]()
AgCl Ag+ + Cl-
L = Ag+ Cl-
Ag = L / Cl- ahol L = állandó
Cl- a KCl koncentrációja határozza meg
az [Ag+] koncentráció növekedés hatására L miatt a felesleg AgCl formában kiválik, mert oldhatósági szorzat értelmében L-nek állandónak kell maradnia
* ha az elektród katódként van kapcsolva
a katódfolyamat Ag+ + e- = Ag0, az [Ag+] koncentráció csökken, hogy L állandó maradjon az AgCl csapadék oldódik, így növeli az a csapadék feletti oldatban az [Ag+] koncentrációját.
Ezzel a mechanizmussal az oldékonysági szorzat biztosítja az [Ag+] koncentráció állandóságát, így a potenciál állandóságát.
Hg Hg2Cl2 KCl elektród müködése:
itt is létezik az anion koncentrációjától függöen telített ;
* ha anód, akkor 2Hg0 - 2e- = Hg22+
[Hg22+ ] nö, de csapadék formájában leválik, hogy az oldahatósági szorzat állandó legyen
![]() Hg2Cl2 Hg22+ + 2Cl-
Hg2Cl2 Hg22+ + 2Cl-
L = [Hg22+ ]. [Cl-]2
[Hg22+] = L / [Cl-]2
eH = eoHg + 2,303 lg [Hg22+] = eoHg + 2,303 lg L / [Cl-]2
Állandó állandó
* ha katód, akkor Hg22+ + 2e- =2 Hg°, hogy ne csökkenjen Hg2Cl2 oldódik. ( A Hg (I)-vegyértékü formában, de dimer alakban van jelen Hg22+ ).
Potenciáljuk állandó, annak értékét csak a nehezen oldódó só oldékonysági szorzatán keresztül a jól oldódó só koncentrációja szabályozza, nem polarizálható, így referencia elektródként viselkednek. Ezeket a fémcsapadék-elektródokat másodfajú elektródoknak is hívjuk; müködésük közben az elektrolit ionkoncentrácója állandó, mivel az ionszorzatnak megfelelöen az ionok a csapadékból folyamatosan pótlódnak, ill. a fémionfelesleg a só anionjával csapadék formájában folyamatosan kiválik. Az elektródpotenciált a résztvevö anyagok koncentrációi határozzák meg, ezért a másodfajú elektródok potenciálja igen állandó.

A redoxieletródok és redoxipotenciál
Ha ón(II)-klorid oldathoz vas(III)-klorid oldatot adunk, végbemegy az
![]() Sn2+ + 2 Fe3+ Sn4+ + 2 Fe2+
Sn2+ + 2 Fe3+ Sn4+ + 2 Fe2+
egyensúlyra vezetö redoxifolyamat, amely az alábbi elektronleadás ill. elektronfelvétel alapján értelmezhetö: Az oldatba egy indifferens Pt elektród merül, így az elektródreakció az oxidáció és redukció ennek a felületén megy végbe.
![]() Sn2+ Sn4+ + 2 e (oxidáció),
Sn2+ Sn4+ + 2 e (oxidáció),
![]() Fe3+ + e Fe2+ (redukció).
Fe3+ + e Fe2+ (redukció).
Minthogy ez a redoxifolyamat önként megy végbe, megvan a termodinamikai lehetösége annak, hogy a kémiai reakció révén hasznos munkavégzés történjen. Ehhez az kell, hogy egy arra alkalmas galvánelemben a két részfolyamatot térbelileg elválasszuk. Típusát tekintve az ilyen galvánelemeket redoxielemeknek, az abban lévö elektródokat pedig redoxielektródoknak nevezzük. A redoxielem celladiagramja:
Pt I SnCl2, SnCl4 I I FeCl2, FeCl3 I Pt.
A redoxielektródról és a redoxipotenciálról általánosságban az alábbiakat kell tudnunk. Ha valamely
![]() ox + ne red
ox + ne red
egyensúlyban lévö redoxirendszer oldatába valamilyen indifferens elektród (Pt) merül, ún. redoxielektród jön létre, amely meghatározott körülmények (T, pH) esetén jól definiált potenciált vesz fel az oldattal szemben. Ez az ún. redoxipotenciál, amely kvantitatíve jellemzi a rendszer redukáló ill. oxidáló képességét. Két redoxirendszer közül mindig az rendelkezik nagyobb oxidáló képességgel, amelynek nagyobb a redoxipotenciálja. A viszonyítási pont a redoxipotenciálok esetében is a standard hidrogénelektród potenciálja (eo = 0,00 V).
Termodinamikai meggondolások alapján levezethetö a Nernst-Peters-egyenletként ismert összefüggés, amely szerint a redoxipotenciál:
eT e![]() +
+ ![]()
ahol e![]() a redoxi normálpotenciál, amelyet akkor mérünk,
ha az oxidált és a redukált forma koncentrációja
a T hömérsékletü oldatban egyenlö (V),
a redoxi normálpotenciál, amelyet akkor mérünk,
ha az oxidált és a redukált forma koncentrációja
a T hömérsékletü oldatban egyenlö (V),
R az egyetemes gázállandó,
T az abszolút hömérséklet,
n a redoxifolyamatban résztvevö elektronok száma,
F a Faraday-féle szám (96487 C/mol),
ox és red az oxidált és a redukált forma oldatbeli koncentrációja,
b és a sztöchiometriai számok.
Ha áttérünk tízes alapú logaritmusra, a Nernst-Peters-egyenlet 298 K hömérséklet esetén:
e e![]() +
+ ![]()
Ha a redukált forma elemi állapotú anyagot, pl. fémet jelent (fémelektródok), akkor az elöbbi egyenlet lényegesen egyszerübb alakban is felírható (Nernst-egyenlet):
eT ![]() ,
,
illetve:
e ![]() ,
,
ahol c az elektródfolyadék koncentrációját jelenti mol/dm3-ben.
A redoxpotenciált önmagában mérni nem lehet, itt is ki kell alakítani egy galvánelemet, amelynek egyik elektródja a redoxelektród, a másik pedig egy vonatkoztatási, standard H2 elektród.ÍIgy a redox, illetve a standard redoxpotenciál értékek mindig egy meghatározott [H+] koncentrációra, azaz pH értékre vonatkozóan 25 C°értéken, pedig a standard redoxpotenciál, ahol [H+] = 1 mol/dm3, pH = 0.00. Ezt az értéket ε 0, jelöljük. Általában minél pozitivabb a standard redoxpotenciál értéke, annál erösebben oxidál a rendszer:
erös oxidáció > +1,5 V,közepes oxidácó- +1,5.1,0 V; gyenge oxidáció +0,5 -1; gyenge redukálószer 0,5- -0,05 V, ; közepes redukálószer -0,05-0,5V és erös redukálószer < - 0,5 V .
Az oxidáló és redukálószer relatív, mindig a két rendszert egymáshoz képest kell figyelembe venni és ismerni kell.
( Redox reakciók jellemzésére az rH értéket adják meg: ez annak a H2 gáz prciális nyomásának tízes alapú negatív logaritmusa, amely a az 1 mól/dm [H+] ion koncentrációjú oldatban a Pt lemez felületére nehezedik, amikor az adott redoxpotenciál értéket mérjük ).
A 37. táblázatból látható, hogy milyen lényeges különbség van a fémelektród és a fém-csapadék elektród standardpotenciáljai között, hisz az ezüst elektród (Ag+ I Ag) standard elektródpotenciálja 0,799 V, az AgCl(s)IAg fém-csapadék-elektród standard elektródpotenciálja 0,222 V. Fenti különbségek érthetök, mivel teljesen eltérö elektródreakcióról van szó. A standard elektródpotenciálok ismeretében érthetö, hogy savakban hidrogénfejlödés csak a hidrogénelektródnál negatívabb potenciájú fémek esetén következik be. A pozitív elektródpotenciálú fémek azért nem oldódnak még erös savakban sem, mert a hidrogéniont nem képesek redukálni. Ezzel szemben az atomos hidrogén redukálja a nála pozitívabb elektródpotenciálú fémek ionjait. A halogének közül a klór oxidálja a bromid- vagy a jodidiont, a legerösebb oxidálószer a fluor pedig a kloridiont is képes oxidálni.
A redoxifolyamatok termodinamikája
A redoxifolyamat termodinamikai
hajtóereje a szabadentalpia, melynek csökkenése révén hasznos munkára van
lehetöség. Ha a folyamat egy redoxielemben megy végbe, a hasznos munka
elektromos munkát jelent. Ennek megfelelöen egy standard körülmények
között müködö redoxielem esetében nyerhetö maximális elektromos
munka a szabadentalpia-változás (DG) mértéke.
Hasznos munkavégzés esetén DG<
DG = DeˇnˇF vagy DG = -DeˇnˇF
ahol: De az elektródpotenciálok különbsége,
n a redoxifolyamatban résztvevö elektronok száma,
F a Faraday-féle szám (96487 C/mol).
Ha a reakcióban résztvevö anyagok standard állapotban vannak, akkor a standard szabadentalpia-változás (DGo) arányos a standard elektródpotenciálok különbségével (Deo
DGo = - DeoˇnˇF.
A szabadentalpia-változás és az elektródpotenciálok különbsége közötti összefüggés kémiai folyamatokban az alábbi. Önként lejátszódó folyamatban DG < 0, De > 0.
Egyensúlyban lévö folyamatokban DG és De is egyenlö 0-val. Önként le nem játszódó folyamatban DG > 0, De < 0.
Korábban már beláttuk, hogy standard körülmények között a szabadentalpia-változás a következö összefüggésben van a K egyensúlyi állandóval:
DGo = - RT ln K.
A két utóbbi egyenlet alapján:
DeoˇnˇF = - RT ln K
amiböl:
ln K = ![]() .
.
Fentiek szerint tehát ha egy redoxielem elektromotoros erejét standard körülmények között megmérjük, módunk van a vonatkozó redoxifolyamat szabadentalpia-változását és egyensúlyi állandóját kiszámítani.
Ha összeállítunk standard körülmények között egy olyan galvánelemet, melynek csak egyik elektródja redoxielektród, a másik viszont a standard hidrogénelektród, mivel az utóbbi elektródpotenciálja megállapodás szerint nulla, az elem elektromotoros ereje megegyezik a másik elektród által képviselt redoxirendszer standard potenciáljával (eo
Redoxifolyamatok az anyagcserében
Több biológiailag fontos reakcióban történik elektronátmenet, melyek szabadentalpia-változása az elektródpotenciál értékeiböl számítható. A 38. táblázatban néhány biokémiai reakció pH = 7,00 értéken mért standard elektródpotenciálját tartalmazza (eo'
A biokémiai reakciók vizes oldatokban és pH=7 körüli értéken zajlanak le, ezért a standard elektródpotenciált, valamint a szabadentalpia-változást is megkülönböztetjük biokémiai folyamatokra vonatkoztatva az indexbe tett '-vel.
35. táblázat. Standard elektródpotenciálok 25 oC-on és pH = 7,00 értéken
|
Redoxifolyamat (oxidált + ne- redukált) |
n |
eo' (volt) |
|
a-ketoglutarát szukcinát + CO2(g) |
|
|
|
acetát acetaldehid |
|
|
|
2 H+ + 2 e H2(g) (pH=7,00!) |
|
|
|
NAD+ + H+ + 2 e NADH |
|
|
|
NADP+ + H+ + 2 e NADPH |
|
|
|
acetaldehid etanol |
|
|
|
piruvát laktát |
|
|
|
fumarát szukcinát |
|
|
|
dehidroaszkorbát aszkorbát |
|
|
|
citokróm-c1 (Fe3+) citokróm-c1 (Fe2+) |
|
|
|
˝ O2(g) + 2 H+ + 2 e H2O (l) |
|
|
Az elektródpotenciálok értéke függ a pH-tól, ha a H+ vagy OH is résztvesz a redoxireakcióban. A biokémiai folyamatokban, mivel azok
vizes közegben zajlanak le, ez gyakorlatilag mindig így van. Az
elektródpotenciál vonatkoztatási alapja ilyenkor is a standard
hidrogénelektród, ahol a
[H+] = 1M, azaz a pH = 0,0. Ezért a hidrogénelektród potenciálja pH
= 7,00 értéken nem 0, hanem a Nernst-egyenletböl az alábbiak szerint
számítható:
e eo - ![]() .
.
Az egyenletben eo = 0,0 (a standard hidrogénelektród potenciálja), [termék] = 1 (a H2 gáz nyomását bar-ban kell megadni; 0,1 MPa = 1 bar), [reaktáns] = [H+]2 = [1,00ˇ10-7]2 = 1,0ˇ10-14, ennek megfelelöen az egyenletbe történö behelyettesítéssel a következöket kapjuk:
![]() .
.
A redoxifolyamat elektródpotenciáljából következtethetünk a két redoxirendszer közötti átmenetre, így pl. a nikotinsavamid-adenin-dinukleotid+ (NAD+) az alábbi reakció szerint köti meg a hidrogént:
NAD+ + H+ + 2 e NADH eo' = - 0,32 V.
A piruvát és a hidrogénion közötti reakció pedig az alábbiak szerint írható fel:
piruvát +
2 H+ + 2 e laktát e![]() = -0,19 V.
= -0,19 V.
A két folyamat a standard-elektródpotenciáloknak köszönhetöen úgy kapcsolódik össze, hogy a piruvát redukálódik laktáttá, és a NADH oxidálódik NAD+-vá.
NADH NAD+ + H+ + 2 e e![]() = 0,32 V.
= 0,32 V.
A két redoxifolyamat az alábbiak szerint vonható össze:
piruvát + NADH + H+ laktát + NAD+
Deo' e![]() + e
+ e![]() = 0,32 + (-0,19 V ) = 0,13 V ,
= 0,32 + (-0,19 V ) = 0,13 V ,
melyböl a standard elektródpotenciál változás a Nernst-egyenlet alapján kiszámítható:
DGo' = -nFDeo' = -2 . 96487 JV-1 mol-1 ˇ 0,13 V = -25090 J . mol-1 = -25,09 kJ . mol-1.
A szabadentalpia-változás elöjele negatív, amely azt mutatja, hogy a reakció a felírt irányba önként végbemegy. A fentiekben egy biokémiai reakcióra mutattuk be a standard elektródpotenciál alkalmazását. Itt a redoxifolyamatban résztvevö anyagok egységnyi koncentrációban voltak jelen, mely arányok azonban a valóságban nem fordulnak elö, ezért a Nernst-egyenlet általános alakját kell alkalmaznunk, ha az aktuális elektródpotenciálok értékeit kell számolnunk.
e eo' - ![]() .
.
Ionszelektív elektródák
Az elsö üvegelektródákat a
hidrogénionra szelektív membránok segítségével a pH-mérésére fejlesztették ki.
Ezt követöen nagyon sok ionra (K+, Na+, NH![]() , Ca2+,
Mg2+) fejlesztettek ki ionszelektív elektródokat, melyek alkalmasak
az ionkoncentráció gyors meghatározására, ezért a gyakorlatban nagymértékben
elterjedtek. Az ionszelektív elektródokkal mérhetök olyan töltéssel nem
rendelkezö vegyületek is, melyek megfelelö kémiai reakcióban,
általában enzimek által katalizált folyamatokban, iont szolgáltatnak. Pl. a
karbamid meghatározása során ammóniumionok szabadulnak fel ureázenzim hatására,
mely ammóniumionok ammóniumszelektív elektródokkal mérhetök. A reakció az
ammóniumionra szelektív elektród membránjában ureázenzim segítségével megy
végbe:
, Ca2+,
Mg2+) fejlesztettek ki ionszelektív elektródokat, melyek alkalmasak
az ionkoncentráció gyors meghatározására, ezért a gyakorlatban nagymértékben
elterjedtek. Az ionszelektív elektródokkal mérhetök olyan töltéssel nem
rendelkezö vegyületek is, melyek megfelelö kémiai reakcióban,
általában enzimek által katalizált folyamatokban, iont szolgáltatnak. Pl. a
karbamid meghatározása során ammóniumionok szabadulnak fel ureázenzim hatására,
mely ammóniumionok ammóniumszelektív elektródokkal mérhetök. A reakció az
ammóniumionra szelektív elektród membránjában ureázenzim segítségével megy
végbe:
NH2CONH2(aq)
+ 2 H2O(l) + H+ ![]() 2 NH
2 NH![]() + HCO
+ HCO![]() .
.
karbamid
Koncentrációs elem
Galvánelem akkor is kialakulhat, ha ugyanazt a fémet merítjük annak eltérö koncentrációjú oldatában és az a koncentrációs elem. Pl.
- Ag I AgNO3 oldat II AgNO3 oldat I Ag +
C1 < C2
Ag0 - 1e- = Ag+ Ag+ + 1e- = Ag 0
anódon oxidáció katódon redukció játszódik le
Addig müködik, míg a koncentráció kiegyenlítödik.
Elektromotoros erö:
C1
E = 0,058 lg ----
C2
Ezen az alapon lehet üvegelektróddal lehet pH-t mérni:
[H+] ismert
E = 0,058 lg ----
[H+] x
ahol [H+]ismert és [H+] x ismeretlen pH-jú oldat,
E elektromotoros erö
Elektrolízis
Az elektromos áram hatására lejátszódó kémiai reakciókat elektrolízisnek hívjuk. Az elektrolízis során az elektrolizáló cellában lévö elektrolitba, mely lehet oldat vagy olvadék, két elektród merül. Egyenfeszültséget kapcsolva az elektródra, a cellában az elektrolit pozitív és negatív ionjai elmozdulnak; az anódon az anionok oxidációja, a katódon pedig a kationok redukciója játszódik le.
Elektrolízis: egyenáram hatására kémiai reakció játszódik le
Primer: a töltéssel rendelkezö ionok semlegesítödnek
katódon redukció, anódon oxidáció
Szekunder: a semleges atom reagál egymással = molekula
elektród anyagával (C + O CO, CO2)
oldószerrel (Cl2 + HOH 2HCl + "O")
HCl elektrolízise:
katód (-): 2H+ + 2e = H2 redukció
anód (+): 2Cl- - 2e = Cl2 oxidáció
![]() 2HCl H2+Cl2
2HCl H2+Cl2
2.96500 C
Bomlási feszültség: HCl tartós elektrolíziséhez egy meghatározott feszültség kell, mert a képzödö H2 és Cl2 galván elemet alkot:
katód (-): H2° + 2e = 2H+
anód (+): Cl2 + 2e = 2Cl-
Bomlási feszültség:
az alkalmazott feszültség > mint keletkezö galván elem elektromotoros ereje
Elektrolízis mennyiségi törvényei:
* Faraday I. m= k. i .t ahol m = a levált anyag mennyisége,g
i = áram erössége , A
t = elektrolízis ideje, sec
Q = i . t áthaladó töltés, C = A . sec
k = elektrokémiai állandó
*Faraday II: 1 mol 1 vegyértékü ionhoz 1.
1 mol 2 2.
1 mol 3 3.96500 C
A nátrium-klorid olvadékának elektrolízise során olyan elektródákat kell használni, melyek nem reagálnak az elektrolízis termékeivel, a klórgázzal és a fémnátriummal. A nátrium-klorid elektrolízisénél a nátriumionok a negatív töltésü katódon redukálódnak, a kloridionok pedig a pozitív töltésü anódon oxidálódnak. Az elektrolizáló cellákban a redoxireakciók mellett az elektrolízissel semlegesített részecskék az anód és a katód anyagával is reagálhatnak, vagy abban oldódhatnak. Pl. a konyhasó higanykatódos elektrolízise során a kivált nátrium a higanyban oldódik, s amalgámot képez.
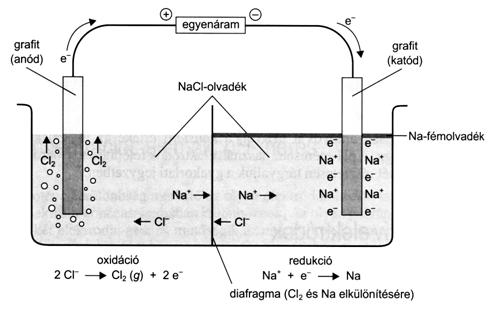
67. ábra. A konyhasó olvadékának elektrolízise
Az elektrolitoldatokban kémiai polarizáció is lejátszódik, melynek következtében az elektrolízis beindításához kellö nagyságú elektromotoros erö, bomlásfeszültség szükséges.
Elektrokémia korrózió
A fémek felületén lejátszódó korrózió elektrokémiai oxidációs folyamat, mely két részreakcióra bontható. Az anódreakcióban a fém oxidációjával fémionok keletkeznek, az elektronok a katódreakcióban használódnak fel, a környezetben található anyagok (O2, H+) redukciójára. A hidrogénionok a vízböl, gyenge savakból (H2CO3) vagy a savas esöböl (H2SO3) származnak. A redukcióban hidroxidionok keletkeznek, melyek a fémionokkal egyesülve korróziós terméket képeznek. A vas korróziója során az alábbi folyamat játszódik le:
Fe(s) = Fe2+ + 2 e
˝ O2(g) + H2O(l) + 2 e- 2 OH
A vas korróziója a vasatomok oxidációjával indul meg, mellyel egyidöben lejátszódik az oxigén redukciója, majd a keletkezett töltéssel rendelkezö részecskék az alábbi egyenlet szerint egyesülnek:
Fe2+ + 2 OH = Fe(OH)2(s).
Ezt a reakciót azonnal követi a vas(II)-hidroxid csapadék gyors oxidációja, melynek során barnaszínü vasrozsda alakul ki:
4 Fe(OH)2(s) + O2(g) = 2 Fe2O3ˇH2O(s) + 2 H2O(l).
vasrozsda
A korrózió elleni védekezés sokféle módszeréböl kiemelésre érdemes a védökatódos eljárás, melynek során a földbe süllyesztett acélcsöhöz fémmagnéziumot kötnek. A kialakuló magnézium-vas galvánelemben a magnézium standard elektródpotenciálja a negatívabb, ezért ez fog oxidálódni, ez lesz az anód, megvédve a vas- vagy acélcsövet a rozsdásodástól.
Elektrokémiai áramforrások
Szárazelemek
A Volta által készített cink-réz galvánelem helyett manapság a Leclanché-elemet használjuk. A cink anód ebben az esetben körbeveszi az NH4Cl-ZnCl2 elektrolit gélt, és az ebbe merülö C-MnO2 katódon játszódik le a mangán(IV)-oxid redukciója az alábbi egyenlet szerint:
Zn(s) +2 MnO2(s) + 2 H2O(l) Zn(OH)2(s) + 2 MnO(OH)(s).
A telep feszültsége 1,5 V; hátránya hogy a redoxireakciók használat nélkül is kis sebességgel lejátszódnak, ezért az elem állás közben is lemerül. Részben kiküszöbölik ezt a hátrányt az alkalikus elemek, melyek legelterjedtebb képviselöje a lúgos mangán(IV)-oxid-cink cella, melynek feszültsége szintén 1,5 V.
A gomb alakú, miniatür alkalikus elemekben cink anód és higany-oxid katód van; feszültségük 1,35 V. A redoxifolyamatokban fémhigany képzödik, ami veszélyes a környezetre, ezért az újabban terjedö, bár rendkívül drága Ag2O katód elönyösebb:
Zn(s) + 2 OH = ZnO(s) + H2O(l) + 2 e (anódreakció),
HgO(s) + H2O(l) + 2 e = Hg(l) + 2 OH (katódreakció).
Akkumulátorok
Az akkumulátorokban végbemenö redoxireakció reverzíbilis, kisütéskor áramot szolgáltatnak, töltéskor pedig ellenkezö irányú kémiai reakció játszódik le bennük. Legismertebb képviselöjük a gépkocsikban használatos ólomakkumulátor, melynek anódja ólomból, katódja pedig ólom-dioxidból készül; elektrolitja pedig a kb. 30%-os kénsavoldat. Az anódon és katódon lejátszódó reverzíbilis folyamatok az alábbiak:
![]() Pb(s) + HSO
Pb(s) + HSO![]() PbSO4(s) + H+
+2 e
PbSO4(s) + H+
+2 e
![]() PbO2(s)
+ 3 H+ + HSO
PbO2(s)
+ 3 H+ + HSO![]() + 2 e PbSO4(s)
+ 2 H2O(l).
+ 2 e PbSO4(s)
+ 2 H2O(l).
Az anódon is és a katódon is kisütéskor oldhatatlan ólom-szulfát-bevonat keletkezik és kénsav használódik fel, miközben mintegy 2 V feszültségü áram termelödik. Az akkumulátor feltöltésekor az elektródreakciók ellentétes irányban játszódnak le. Az ólomakkumulátor hátránya nagy tömege és viszonylag rövid élettartama. A nikkel-kadmium alkalikus akkumulátor élettartama hosszabb, tömege pedig kisebb mint az ólomakkumulátoré. A töltéskor és kisütéskor lejátszódó kémiai reakció a katódon és az anódon az alábbi:
![]()
Cd(s) + 2 OH Cd(OH)2(s) + 2 e
![]() [NiO(OH)](s) + H2O(l) + e Ni(OH)2(s)
+ OH
[NiO(OH)](s) + H2O(l) + e Ni(OH)2(s)
+ OH
A [NiO(OH)] a nikkel-oxid és a nikkel-hidroxid keverékét jelöli. Az akkumulátor feszültsége 1,4 V.
Tüzelöanyag-elemek
Mivel a tüzelöanyagokból elektromos energia elöállítása közvetett módon, az égéskor felszabaduló höenergia átalakításával történik, a közvetett elöállítás miatt a hatásfok maximálisan 40%. Ha a tüzelöanyagok oxigénnel való reakciója közvetlenül a galvánelemben valósulna meg, akkor a hatásfok elérhetné a 80-90%-ot is. Az ilyen galvánelemekben a fosszilis tüzelöanyagok reakciója a levegö oxigénjével az oxigénre közömbös elektródok közvetítésével játszódik le, miközben a termelt elektromos energiát folyamatosan elvezetik.
 Megbízhatóan
müködik már a hidrogén-oxigén tüzelöanyag-cella, melyet
széleskörüen alkalmaznak nagy fajlagos teljesítménye miatt pl. az
ürhajózásban. A cellareakció a hidrogéngáz égése:
Megbízhatóan
müködik már a hidrogén-oxigén tüzelöanyag-cella, melyet
széleskörüen alkalmaznak nagy fajlagos teljesítménye miatt pl. az
ürhajózásban. A cellareakció a hidrogéngáz égése:
2 H2(g) + O2(g) 2 H2O(l).
Az oxidáció és redukció térben elkülönítetten, alacsony hömérsékleten játszódik le az alábbiak szerint:
2 H2(g) + 4 OH = 4 H2O(l) + 4 e (anódreakció),
O2(g) + 2 H2O(l) + 4 e = 4 OH (katódreakció).
Meg kell jegyezni azt is, hogy a reakció mellékterméke, a víz, rendkívül
hasznos, létfontosságú vegyület az ürhajózásban résztvevöknek.
Találat: 6574