| kategória | ||||||||||
|
|
||||||||||
|
|
||
A nyíltláncú és gyürüs telítetlen szénhidrogének közül az egy vagy több szén-szén kettös kötést tartalmazó vegyületeket összefoglaló néven alkéneknek és cikloalkéneknek nevezzük.
Az alkének kis mennyiségben a köolaj, a földgáz és a köszénkátrány alkotói. A növényvilágban általánosan elterjedtek mind a nyílt szénláncú, mind pedig az aliciklusos telítetlen szénhidrogének, mégpedig föként az izoprén egységekböl felépülö terpének és karotinoidok formájában.
A nyílt szénláncú, legalább egy kettös kötést tartalmazó alkének gyakori megnevezése az olefin. Az egy kettös kötéssel rendelkez 717f53h ö olefinek homológ sorának általános képlete CnH2n.
Az olefinekben található kettös kötések száma alapján megkülönböztetünk mono-, di- és poliolefineket. A kettös kötések egymáshoz viszonyított helyzete szerint a diolefin lehet izolált, konjugált és kumulált.
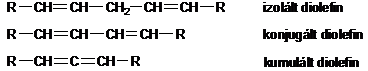
Az alkének és cikloalkének nevét az azonos szénatomszámú alkán és cikloalkán nevéböl vezetjük le úgy, hogy az -án végzödést -én végzödésre cseréljük.
A szénláncot, illetve a gyürüt úgy számozzuk meg, hogy a kettös kötés a lehetö legkisebb helyzetszámot kapja. A többszörös kötéshez tartozó szénatomok közül a névben általában csak a kisebb helyzetszámot adjuk meg. Több kettös kötés jelzésére - cikloalkének esetén is - az (a)dién, (a)trién stb. végzödések szolgálnak.
Az elágazó szénláncot tartalmazó olefinek esetén az alapvegyületet úgy választjuk ki, hogy a lehetö legtöbb kettös kötést tartalmazza.
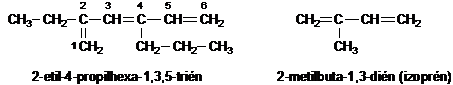
Az alapvegyületekböl levezetett egy- és többértékü csoportneveket -il, -diil stb. végzödésekkel képezzük.
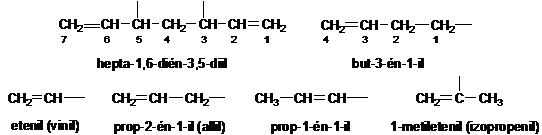
Az alkénekben a kettös kötések pillératomjai sp2 hibridállapotúak, azaz a három hibridpálya 120 -os kötésszöget alkotva síkszerkezetü, a nem-hibridizált pz-pálya pedig erre a síkra meröleges. A legegyszerübb olefinben, az eténben mindkét szénatom három hibridpályája s-kötéssel kapcsolódik két-két hidrogénhez, illetve a másik szénatomhoz, és így alakul ki a molekula s-váza. A pz-pályák átlapolásával pedig kialakul a szénatomok közötti második kötés, a p-kötés.
A pz-pályák maximális átfedése, azaz a molekula energiaminimuma akkor valósulhat meg, ha a két szénatom s-váza egy síkban helyezkedik el.

Az így kialakult kettös kötés kötéstávolsága 134 pm, ami jóval rövidebb, mint az etánra jellemzö 154 pm-es szén-szén kötéstávolság.
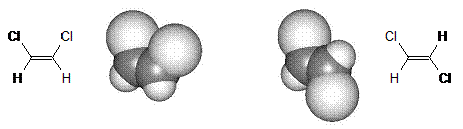
A szén-szén kötés mentén elforgatva a két szénatomot a p-pályák átlapolása és a kötéserösség csökken, 90 -os elforgatásnál meg is szünik, és a p-kötés felszakad. Ennek a folyamatnak az energiaigényét (200-250 kJ mol-1) szobahömérsékleten a hömozgás átlagos energiája messze nem fedezi, ezért az olefinekben a C=C kötés mentén gátolt a rotáció. Ezért az 1,2-diszubsztituált etének (pl. 1,2-diklóretén) esetében cisz-transz (Z-E) izoméria jelensége lép fel (l. ???. old.), és az izomerek egymással diasztereoméria viszonyban állnak.
Az olefinek kettös kötését a már korábban a ciklopropán esetében tárgyalt hajlított- vagy banánkötésként is értelmezhetjük, mégpedig úgy, hogy az sp2 hibridpálya és a pz-pálya összeolvadásával (újrahibridizációjával) két egyenértékü hajlított kötés (t-kötés) jön létre, amiben 17% az s- és 83% a p-pályák részesedése.
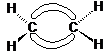
A legegyszerübb konjugált poliolefin a buta-1,3-dién, melynek valamennyi szénatomja sp2 hibridállapotú. A síkszerkezetü molekula s-transz és s-cisz konformációban fordulhat elö. Az elnevezésben az s-elötag a "single-bond" (egyszeres kötés) angol szóösszetételre utal.
A buta-1,3-dién két konformációja:
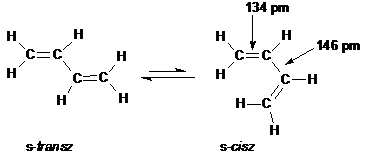
Mindkét konformációban megvalósulhat a pz-pályák átlapolása, ami azt eredményezi, hogy a négy pz pályán lévö elektron két delokalizált molekulapályát hoz létre (l. ???. old. ???. ábra). Ezzel magyarázható az a tény, hogy a butadién két középsö szénatomja között a távolság kisebb (146 pm), mint az etán C-C s kötésének (154 pm) távolsága, tehát az egyszeres kötésnél erösebb kötés jön létre.
A delokalizáció hatása a vegyület energiatartamában is megnyilvánul - azaz alacsonyabb, mintha két izolált kettös kötést tartalmazna. Ezt az energiakülönbséget delokalizációs energiának nevezzük, nagysága butadién esetében - égéshö adatok alapján - 12 kJ mol-1. A konjugált kettös kötések számának növekedésével a HOMO és a LUMO molekulapályák energiaszintje egyre közelebb kerül egymáshoz (l. ???. old.), és ez a konjugált poliének esetében azzal a következménnyel jár, hogy a vegyületeket már a látható fény is gerjeszti, ezért színesek (2.4. ábra).
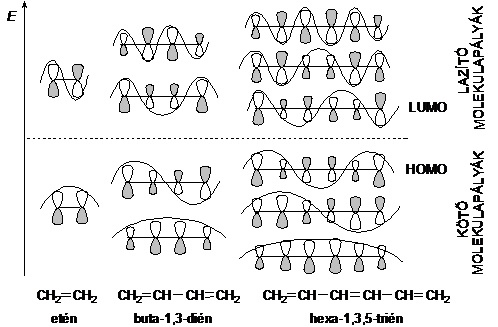
2.4. ábra. A konjugált poliének gerjeszthetösége
A kumulált diének legegyszerübb képviselöje a propadién (allén).
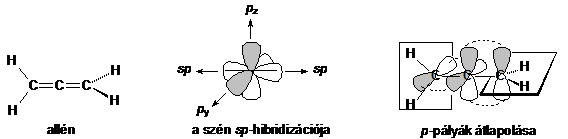
Az allén középsö szénatomjához csak két ligandum kapcsolódik két-két kettös kötéssel, tehát ez a szénatom sp hibridizációjú. Ez a láncvégi sp2 hibridállapotú szénatomokhoz a nem-hibridizált pz-pályáival egymással 90 -os szöget bezáró síkja mentén két ortogonális (egymásra meröleges) p-kötést alkotva kapcsolódik. A gátolt rotáció miatt az 1,3-diszubsztituált allének királis molekulák, ezért nemracém halmazuk optikailag aktív.
Az olefinek energiatartama sokkal nagyobb, mint az azonos szénatomszámú alkánoké, amit az is bizonyít, hogy az alkének hidrogénezési reakciójában jelentös mennyiségü hö szabadul fel. A különbözö strukturális helyzetü kettös kötést tartalmazó olefinek, illetve az izomer olefinek hidrogénezési höinek összehasonlításából következtethetünk az olefinek relatív stabilitására.
Vegyület |
DH hidr. (kJ mol-1) |
|
CH2=CH2 |
|
|
CH2=CH-CH2-CH3 |
|
|
CH2=CH-CH3 |
|
|
|
|
|
(Z)-CH3-CH=CH-CH3 |
|
|
(E)-CH3-CH=CH-CH3 |
|
|
CH2=CH-CH=CH2 |
|
|
CH2=CH-CH=CH-CH3 |
|
|
CH2=CH-CH-CH=CH2 |
|
|
CH3-CH=C=CH-CH3 |
|
Az adatokból látható, hogy a kettös kötés pillératomjainak szubsztitúciója növeli az olefinek stabilitását. A geometriai izomerek közül a E-izomer a stabilabb, mert a nagyobb térkitöltésü szubsztituensek távolabb vannak egymástól, mint a Z-izomerben. A diének esetében a konjugáció, mint már utaltunk rá, szintén stabilizáló hatású, ezzel szemben a kumulált diéneket nagyfokú instabilitás jellemzi, melynek oka a két izolált elektronpár térbeli közelségéböl eredö kölcsönös taszítás.
Az alkánok reakcióinak tárgyalása során már találkoztunk a földgáz és a köolaj krakkolásával (l. ???. old.). A vegyipar ezzel a módszerrel nagymennyiségü etént állít elö.
Megfelelö vízelvonószer (cc.H2SO4 vagy ZnCl2, H3PO4 stb.) hatására, vagy magas hömérsékletü dehidratáló kontakton bekövetkezö intramolekuláris vízkilépéssel az alkoholokból olefinek képzödnek (pl. Al2O3, 350 C).
![]()
A reakciót befolyásoló tényezöket az alkoholok tárgyalása során (l. ???. old.) részletezzük.
Bázis hatására vagy magasabb hömérsékleten az alkil-halogenidekböl olefinek képzödnek.
![]()
A reakció mechanizmusát az alkil-halogenidek reakcióinál (l. ???. old.) elemezzük.
![]()
A reakciókörülményektöl függöen cisz vagy transz izomerhez jutunk: a katalitikus hidrogénezés - a korábban már megismert mechanizmus szerint (l. ???. old.) - cisz izomert eredményez, míg a fémnátriummal cseppfolyós ammóniában végzett redukció a transz izomer képzödésének kedvez.
A Wittig-reakciót és az aldol típusú reakciókat az Oxovegyületek c. fejezetben (l. ???. old.) tárgyaljuk.
Vízben gyakorlatilag oldhatatlanok.
A telítetlen szénhidrogének gyakran alkalmazott kiindulási anyagok a különféle szerves vegyületek elöállításánál. A nagyfokú reakciókészség és a változatos átalakítási lehetöségek révén olefinekböl elöállíthatunk többek között alkánokat, alkil-halogenideket, alkoholokat, étereket, aldehideket, ketonokat, karbonsavakat, cikloalkánokat és polimer vegyületeket.
Az olefinek jellemzö reakciója az addíció. Az addíciós folyamatban a reakciópartner (XY) hozzákapcsolódik az olefinkötés szénatomjaihoz, miközben a kettös kötés felnyílik, és az sp2 hibridállapotú szénatomok sp3 hibridállapotúvá alakulnak. A reakció energetikailag kedvezö, mivel a nagy energiatartalmú olefinböl kisebb energiatartalmú telített származék képzödik. (pl. HCl vagy Br2 addíciónál alkil-halogenid).
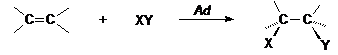
A katalitikus hidrogénaddíció részleteit az alkánok elöállítása során már korábban tárgyaltuk (l. ???. old.). Az alábbiakban az elektrofil addíciót (AdE) és a gyökös addíciót (AdR) ismertetjük.
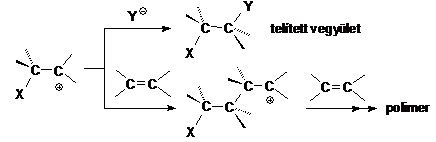
Oldatfázisban többnyire lehetöség van az XY reagens nagyobb energiaigényü heterolitikus kötéshasadására. Ilyen esetben az oldószer szolvatálja a képzödö ionokat, és a szolvatációs energia részben vagy egészben fedezi a disszociációs energiát. Ha az XY reagens heterolitikus disszociációja során X+ kation és Y- anion képzödik, akkor a továbbiakban a kation elektrofil támadást indít az olefin nagy elektronsürüségü p-kötésre. Ez az elsö lassú lépés a kétlépéses reakció sebességmeghatározó lépése, melyben egy karbokation képzödik.

A karbokation a reakció második lépésében reagálhat az Y- nukleofillel, és telített vegyület keletkezhet, de reagálhat egy másik olefinnel is, amikor kationos polimerizáció mechanizmusa szerint polimer láncmolekula képzödhet.
Alkének reakciója haloid savakkal (HX-addíció)
Olefinek könnyen addícionálnak hidrogén-halogenideket, miközben alkil-halogenidekké alakulnak. A reakció megvalósítható úgy, hogy a cseppfolyós olefineken hidrogén-halogenid gázt buborékoltatnak keresztül, vagy az olefinek oldatát haloidsav tömény vizes oldatával reagáltatják. Ez utóbbi esetben H2O-addícióval (alkoholok képzödésével) is számolni kell. Az elektrofil addíció mechanizmusa szerint a reakció elsö lépésében az olefin a protonnal reagál. A karbokation mint köztitermék a nukleofil halogenidionnal a reakció második lépésében alkil-halogeniddé alakul. Például, az etén és a hidrogén-bromid reakciója etil-bromidot eredményez.
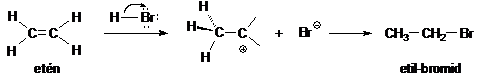
:
3404