| kategória | ||||||||||
|
|
||||||||||
|
|
||
ELEGYEK ÉS OLDATOK
Az elegyek kémiailag egységes anyagokból álló homogén rendszerek, melyekben az alkotórészek eloszlása molekuláris és/vagy ionos szinten áll fenn, s így azokban fénymikroszkóppal különbségek nem észlelhetök.
Elegyek mindhárom halmazállapotban elöfordulnak. Gáz halmazállapotú elegy pl. a levegö, amely nitrogén, oxigén és egyéb gázok keveréke. A folyékony halmazállapotú elegy lehet az anyagok halmazállapotától függöen folyadékban oldott gáz (pl. szódavíz, amely a CO2 vizes oldata), folyadékban oldott folyadék (etanol és víz elegye), és folyadékban oldott szilárd anyag (cukoroldat, konyhasóoldat). A szilárd halmazállapotú elegy lehet gáz-szilárd (platinában oldott H2-gáz), folyadék-szilárd (fémekben oldott Hg, amalgámok), és szilárd-szilárd (fémötvözetek). Az igen sokféle elegy közül gyakorlati szempontból a folyadékfázisban képzödö oldatok (gáz-folyadék, folyadék-folyadék és szilárd-folyadék) jelentösek, ezért a továbbiakban elsösorban ezek tulajdonságaival foglalkozunk. Ezek közül még külön is kiemelésre érdemesek, gyakorlati jelentöségük miatt, a gáz- és a folyadék-halmazállapotú elegyek. Azokat a kondenzált fázisú (folyadék vagy szilárd) elegyeket, melyek túlnyomó részét egyetlen komponens teszi ki, oldatoknak nevezzük. A folyadék-halmazállapotú elegyek említett komponensére általánosan az ''oldószer'' elnevezés használatos, a másik, ill. a többi alkotórészt pedig oldott anyag(ok)nak nevezzük.
Az elegyek és oldatok termodinamikai jellemzésére a P, V és T állapothatározókon kívül a koncentrációt (vagy annak reciprokát, a higítást) is meg kell adni.
Folyadék halmazállapotú oldatok
Az oldás jobbára fizikai folyamat, melyben az oldandó anyag és az oldószer kölcsönhatásából keletkezik az oldat. A gázok és egyes folyadékok könnyen, tetszöleges arányban elegyedhetnek egymással. Az oldatok többségénél azonban az alkotórészek csak meghatározott arányok között változhatnak. Az oldandó anyag mennyiségének növelésével az oldószer egy adott mennyiség feloldása után további anyagot már nem képes feloldani az adott hömérsékleten, az oldott anyagra nézve telítetté válik. A telített oldathoz adott további oldandó anyag az oldattól szilárd fázisban elkülönül, a két fázis között az oldandó és az oldott anyag tekintetében dinamikus egyensúly alakul ki. Ennek során idöegység alatt ugyanannyi anyag megy oldatba, mint amennyi kiválik, tehát az oldott és az oldandó anyag molekulái kicserélödnek egymással a koncentráció változatlanul maradása mellett. Meghatározott hömérsékleten a telített oldat koncentrációját az oldott anyag oldhatóságának nevezzük. A telített oldatnál töményebb oldatokat túltelített oldatoknak hívjuk. Ezek az oldatok nem stabilak, mikroszennyezések hatására, vagy az oldott anyag kristályának bevitelére (oltókristály), vagy esetleg mechanikai hatásra
gyors kristályosodás indul meg, melynek végén kialakul a telített oldatra jellemzö összetétel.
Az oldódás a szilárd-folyadék határfelületen következik be, ezért minél nagyobb a szilárd anyag felület 828b14i e, annál gyorsabb az oldódás. A felület növelésével, az oldat rázásával ill. keverésével az oldódás sebessége növelhetö, de nem befolyásolja az oldószer által feloldott anyag mennyiségét, a telített oldat koncentrációját.
Mivel az oldódás során kölcsönhatások alakulnak ki az oldat összetevöi között, ezért a molekulaszerkezet és az oldhatóság között szoros kapcsolat van. Pl. vízben - mivel a víz poláris jellegü oldószer - az apoláris gázok és folyadékok csak kismértékben, a poláris csoportot is tartalmazó vegyületek nagyobb mértékben, az ionkristályok pedig kifejezetten jól oldódnak. Gyakorlati tapasztalat, hogy hasonló hasonlóban oldódik, ami azt jelenti, hogy a dipólus molekulák poláris oldószerekben, az apoláris anyagok viszont apoláris szerkezetü anyagokban oldódnak jól.
Általában azok az anyagok oldódnak fel nagyon könnyen, ahol az oldott anyag és az oldószer molekulái között ugyanolyan kapcsolatok alakulnak ki, mint amilyenek az oldandó anyagot és az oldószer-molekulákat is összetartják. Így pl. a benzol és a toluol jól elegyedik egymással, mivel a benzol-benzol, a toluol-toluol és a benzol-toluol molekulák között is a London-féle kölcsönhatások hatnak. Poláris molekulák apoláris oldószerben egyáltalán nem vagy alig oldódnak, jól oldhatók viszont vízben, mivel ott dipólus-dipólus vagy dipólus-ion kölcsönhatások alakulhatnak ki.
Az anyagok oldhatóságát azonban nem
csak a kölcsönhatások jellege, hanem azok erössége is jelentösen
befolyásolja. A Ca3(PO4)2 esetében a
kristályrács ionokból épül fel, oldhatósága vízben mégis rossz, mivel a Ca2+
és a ![]() ionok és a
vízmolekulák közt kialakuló kölcsönhatás erössége kisebb, mint az ionok
közötti vonzóerö a kristályrácsban. Ezzel szemben a NaCl vízben jól, míg a
poláris szerkezetü etanolban alig oldódik. Az etanol és a Na+
ill. a Cl között kialakuló ion-dipólus
vonzóerök nem elegendöek a kristályrácsban az ionok között ható
vonzóerök megszüntetéséhez. Azok az anyagok, amelyek apoláris és poláris
részeket is tartalmaznak, jól oldódnak mind poláris, mind apoláris
oldószerekben. Így pl. az etil-alkohol a poláris hidroxil csoportjai miatt
vízben is jól oldódik, mivel OH csoportjai hidrogénkötéseket alakítanak ki a
vízmolekulákkal, ezért az etilalkohol és a víz egymással korlátlanul elegyedik.
A homológ sorban az alkilcsoportok szénatom számának növekedésével, az apoláris
jelleg fokozódásával oldhatóságuk vízben csökken, növekszik viszont az
oldhatóság apoláris oldószerekben.
ionok és a
vízmolekulák közt kialakuló kölcsönhatás erössége kisebb, mint az ionok
közötti vonzóerö a kristályrácsban. Ezzel szemben a NaCl vízben jól, míg a
poláris szerkezetü etanolban alig oldódik. Az etanol és a Na+
ill. a Cl között kialakuló ion-dipólus
vonzóerök nem elegendöek a kristályrácsban az ionok között ható
vonzóerök megszüntetéséhez. Azok az anyagok, amelyek apoláris és poláris
részeket is tartalmaznak, jól oldódnak mind poláris, mind apoláris
oldószerekben. Így pl. az etil-alkohol a poláris hidroxil csoportjai miatt
vízben is jól oldódik, mivel OH csoportjai hidrogénkötéseket alakítanak ki a
vízmolekulákkal, ezért az etilalkohol és a víz egymással korlátlanul elegyedik.
A homológ sorban az alkilcsoportok szénatom számának növekedésével, az apoláris
jelleg fokozódásával oldhatóságuk vízben csökken, növekszik viszont az
oldhatóság apoláris oldószerekben.
A hömérséklet és a nyomás hatása az oldhatóságra
Oldáshö, az a hömennyiség, amely elnyelödik, vagy felszabadul, ha egy mól anyagból híg oldatot készítünk (Híg oldat, ha egy oldott anyagra 100 vagy annál több oldószer molekula jut, míg ha 1 oldott anyagra kevesebb, mint 100 oldószer molekula jut, akkor tömény oldat. Híg oldatok esetében az oldószer hidrát burkot alkot, és a részecskék között nem alakulhat ki kölcsönhatás). Az oldáshö elöjele a hidratációs hö és rácsenergia viszonyától függ. Ha a rácsnergia nagyobb, mint a hidratációs energia, az oldáshö elöjele pozitív, míg ha a hidratációnál nagyobb energia szabadul fel, mint a rács felbontásához kell, akkor az oldáshö negatív.
Ha a folyamat höfelszabadulással jár, azaz az oldat felmelegszik, az oldódás exoterm, ha a folyamat höfelvétellel jár, azaz az oldat lehül, endoterm az oldás. Fentiek miatt az anyagok oldhatóságát a hömérséklet jelentösen befolyásolhatja. Az anyagi minöségtöl függöen a hömérséklet emelésével az oldhatóság nö (pl. KI, NaNO3), nem változik lényegesen (pl. NaCl), vagy csökken (pl. KBr).
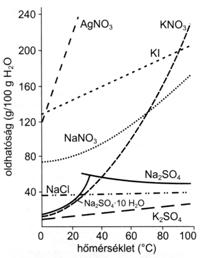
29. ábra. A hömérséklet hatása az oldhatóságra
Az exoterm vagy endoterm jelleg alapján az anyagok oldhatóságának változása a hömérséklettel becsülhetö. Exoterm oldódási folyamat esetén az oldhatóság a hömérséklet emelésével csökken, endoterm oldódás esetén az oldhatóság a hömérséklet emelésével növekszik. Ha nem kíséri höváltozás az oldódást, akkor az oldhatóság független a hömérséklettöl.(Ebben az esetben a rácsenergia és a hidratációs hö azonos nagyságú). Gázok oldhatósága a hömérséklet emelésével csökken, ezért az oldószerrel reakcióba nem lépö gázok az oldatból forralással eltávolítható.
A gázok oldhatóságát a nyomás befolyásolja. Henry-törvénye szerint az oldószerrel reakcióba nem lépö gázok oldhatósága (c) arányos a gáznak az oldat felett mért parciális nyomásával (P):
c = a ˇ P,
ahol a a gáz anyagi minöségétöl és a hömérséklettöl függö állandó.
Megoszlás és megoszlási hányados
Ha egy oldatot egy vele nem elegyedö oldószerrel alaposan összerázunk, az oldott anyag egy része az utóbbiba átoldódik, és a két fázis termodinamikai egyensúlyba kerül. Jellemzö erre, hogy a két fázist tekintve az oldott anyag koncentrációaránya meghatározott érték; az oldott anyag A és B oldószerben mért cA, cB koncentrációjának hányadosa a megoszlási hányados (K):
![]() .
.
Ez a megoszlási törvény, melyet a koncentrációaránnyal ill. a megoszlási hányadossal tudunk kifejezni. Híg oldatok esetében a megoszlási hányadost csak az anyagi minöség (oldószerek és oldott anyag), valamint a hömérséklet szabja meg. Lényeges az is, hogy a rendszerben jelenlévö egyéb anyagok is hatással lehetnek a megoszlásra, és fontos az is, hogy a megoszlási törvény csak akkor érvényesül, ha az oldott anyag molekuláris állapota mindkét fázisban megegyezik.
A megoszlási törvény képezi az alapját a különbözö extrakciós, pontosabban folyadék-folyadék extrakciós eljárásoknak. Ezek révén egy viszonylag nagy térfogatú híg oldatban lévö anyagot úgy koncentrálunk, hogy ezt az oldatot összerázzuk olyan oldószernek kis mennyiségével, amely a kérdéses anyagot jobban oldja. Minthogy a különbözö oldott anyagok megoszlási hányadosa adott oldószerpár esetén legtöbbször eltérö, az extrakció többé-kevésbé szelektív, és így az anyagok tisztítására is alkalmas lehet.
Az odatok töménysége - koncentrációegységek
Az anyag mennyiségének kifejezésére használt egységektöl függöen az oldatok koncentrációját a következök szerint adhatjuk meg.
A tömegszázalék (m/m%) megmutatja, hogy
az oldott
5m/m%-os CuSO4
azt jelenti : hogy
A térfogatszázalék ( v/v%) megmutatja, hogy 100 cm3 oldatban hány cm3 oldott anyag van. Pl.
96 v/v%-os etilalkohol azt jelenti, hogy 100 cm3 oldatban van 96 cm3 etilakohol.
A vegyesszázalék (m/v%) megmutatja, hogy 100 cm3 oldatban hány g oldott anyag van.Pl.
10 m/v%-os NaCl
oldat azt jelenti, hogy100 cm3 oldatban hány
Az anyagmennyiség koncentráció (molaritás) megmutatja, hogy az oldat 1 dm3-e hány mol oldott anyagot tartalmaz, illetve a molekulatömegnyi anyagot tartalmazza.
Jele: M vagy pedig
a vegyület képlete szögletes zárójelbe (
Pl. Az összes levezetés a továbbiakban mindig ilyen értelemben tartalmazza koncentrációt.
A molalitás megmutatja, hogy
A mól százalék (n/n%) megmutatja, hogy 100 mól oldatban hány mól oldott anyag van . Pl.
5 n/n%-os HCl oldat azt jelenti, hogy 100 mól oldatban 5 mol HCl és (100-5)= 95 mól víz van. (Kiszámítása : n/n% = 100 x XA, ahol XA az oldott anyag móltörtje)
A móltörtet (X) megkapjuk, ha az oldat egyik komponense móljainak számát az oldatban lévö összes komponens móljainak számához viszonyítjuk. Az oldat A, B, C, .... I komponensei móljainak száma nA, nB, nC, .... nI, akkor az A komponens móltörtje (XA) a következöképpen számítható:
XA
= ![]() .
.
( A móltörtek összege mindig egyenlö 1-el
A fenti koncentrációegységekben kifejezett koncentrációk közül azok, amelyekben a térfogat is szerepel (térfogat %, vegyes %, molaritás) a hömérséklettöl függenek, mivel az oldat térfogata a hömérséklettel változik. Ezért ezeknél a koncentrációknál meg kell adni azt a hömérsékletet, amelyekre a koncentráció érvényes. A tömeg %, a molalitás és a móltört függetlenek a hömérséklettöl.
E koncentrációegységek használata akkor kívánatos, amikor azt vizsgáljuk, hogy hogyan befolyásolja az oldott anyag az oldószer tulajdonságait. (A leggyakrabban használt koncentráció a mól/dm3, a reakciósebesség, egyensúlyok és elektrokémia esetében a koncentrációk mindig ilyen értelemben használatosak).
Ideális és reális elegyek (oldatok)
Ideálisnak tekintjük azokat az elegyeket, amelyekben az azonos és a különbözö minöségü molekulák közti kölcsönhatások gyakorlatilag nem különböznek egymástól. Jellemzö ezekre többek között az, hogy képzödésükkor a térfogat is és az entalpia is additív. Ez azt jelenti, hogy komponenseiknek térfogata ill. entalpiája egyszerüen összeadódik. Az utóbbi következtében az ideális elegyek (oldatok) elegyítési (oldási) höje nulla.
Ideális elegyet képeznek pl. a tökéletes gázok, a különbözö szerves izomerek és a szénatom számuk tekintetében egymáshoz közel álló homológ vegyületek, néha azonban a kémiailag egymástól távolabb állók között is találunk erre példákat (benzol-naftalin).
Az ún. reális elegyekben a különféle molekulák kölcsönhatása számottevöen eltér az azonos minöségü molekulák kölcsönhatásától. Ennek egyik legszembetünöbb következménye az, hogy a reális elegy térfogata kisebb vagy nagyobb, mint a komponensek térfogata (kontrakció ill. dilatáció). A reális elegyek többek között abban is különböznek az ideálisaktól, hogy képzödésük höleadással vagy hö fejlödéssel jár.
Az ideális elegyek göznyomása (Raoult-törvény)
Az ideális
oldatokra érvényes Raoult törvénye, amely kimondja, hogy egy A és B illékony
komponensböl álló oldat felett az egyes komponensek parciális göznyomása,
PA és PB arányos a komponensek oldatbeli móltörtjével (XA,
XB), és a komponensek tiszta állapotban mért göznyomásával (P![]() és P
és P![]() ):
):
PA
= XA ˇ P![]() és PB = XB ˇ P
és PB = XB ˇ P![]() .
.
Az oldat göznyomása a parciális göznyomások összege, azaz:
Poldat = PA + PB.
Ha a komponensek tiszta állapotban mért göznyomása különbözö, akkor az oldat felett kialakuló göz összetétele különbözik az oldat összetételétöl. Egy ideális oldat feletti göz minden hömérsékleten nagyobb koncentrációban tartalmazza az illékonyabb komponenst. Ez az illékony komponensekböl álló folyadékelegy frakcionált desztillációval történö szétválasztásának az alapja.
Bár ideális oldatok gyakorlatilag nem léteznek, de néhány oldat, amely olyan komponensekböl jön létre, melyek szerkezetükben csak kissé térnek el egymástól, megközelíti azt (pl. benzol és toluol vagy n-hexán és n-heptán elegye).
Ionos oldatok közül azok közelítik meg legjobban az ideális állapotot, amelyekben az ionok koncentrációja olyan alacsony, hogy azok egymásra gyakorolt kölcsönhatása elhanyagolható. A reális oldatok jelentös eltérést mutathatnak a Raoult-törvénytöl. Ha az A és B komponensböl képzödö oldat esetében az A-B molekulák közötti vonzóerö nagyobb, mint az A-A és a B-B molekulák között, akkor negatív irányú az eltérés a Raoult-törvénytöl; a komponensek parciális göznyomása az oldat felett kisebb, mint ami a tiszta állapotban mért göznyomásból és a móltörtböl számítható. Az ilyen oldatok képzödése exoterm, a hömérséklet növelésével az oldhatóság csökken. Ha az A-B molekulák közötti vonzóerö kisebb, mint az A-A és a B-B molekulák közötti, akkor pozitív lesz az eltérés a Raoult-törvénytöl, tehát a komponensek parciális göznyomása az oldat felett nagyobb lesz, mint ami a móltörtböl és a tiszta állapotban mért göznyomásból számítható. Az ilyen oldatok képzödése endoterm; a hömérséklet növelése az oldhatóságot növeli.
Az oldatok fagyáspontcsökkenése és forráspont-emelkedése
A nem illékony anyagot tartalmazó oldatok göznyomása kisebb a tiszta oldószer göznyomásánál. Az oldószer és az oldott anyag kölcsönhatásával az oldószer-molekulák egy része megkötödik, csökkentve ezzel a göztérbe kilépni képes oldószer-molekulák számát, ami az oldat kisebb göznyomásához vezet. Az oldat göznyomása minden hömérsékleten alacsonyabb, mint az oldószeré. A tiszta oldószer forráspontján az oldat göznyomása még kisebb, mint 0,1 MPa, ezért az oldatot tovább kell melegíteni, ha azt el akarjuk érni. Ennek következtében az oldat forráspontja magasabb, mint az oldószeré. Mivel az oldatnak kisebb a göznyomása, mint az oldószernek, az oldat göznyomásgörbéje a szilárd oldószer szublimációs görbéjét a hármaspont, és az oldószer fagyáspontjának megfelelö érték alatt metszi, s így az oldat fagyáspontja kisebb lesz a tiszta oldószer fagyáspontjánál.

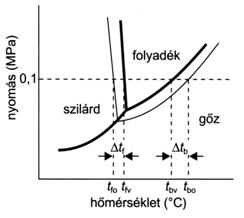
Az oldat fagyáspontcsökkenése és forráspont-emelkedése szorosan összefügg a göznyomáscsökkenéssel, mivel mindkettö csak a feloldott anyag móljainak számától függ. A híg oldatok tenziócsökkenése, fagyáspontcsökkenése és forráspont-emelkedése az ún. kolligatív tulajdonságok közé tartozik. Ez alatt azt értjük, hogy az említett tulajdonságok csak az adott rendszer tömeg- vagy térfogategységnyi mennyiségében lévö molekulák és ionok számától függenek (pl. az oldott anyag móljainak számával arányosak), de függetlenek az oldott anyag anyagi minöségétöl.
A híg oldatok esetében mindig fagyáspontcsökkenés és forráspont emelkedés lép fel, amelyböl az anyag molekulatömege kísérleti adatok alapján meghatározható.
Az ozmózis
A természetben elöforduló hártyaszerü képzödmények (setjmembrán, sejtfal), valamint néhány mesterségesen elöállított anyag (cellofán, müanyagfóliák) egyik sajátsága, hogy a kisméretü, töltéssel nem rendelkezö molekulákat mindkét irányban képesek átbocsátani, míg a nagyobb méretü vagy töltéssel rendelkezö ionokat visszatartják. A féligáteresztö membránok pórusmérete lehetövé teszi mindkét irányban a kisméretü molekulák diffúzióját, de megakadályozza a nagyméretü molekulák és ionok átjutását. Ha egy oldatot és a neki megfelelö tiszta oldószert egy U-alakú csöben féligáteresztö membránnal elválasztunk, ozmózis jelenséget figyelhetünk meg. Kezdetben az oldat és az oldószer szintje az U-alakú csöben azonos. Ha nem lenne a féligáteresztö membrán az oldószer és az oldat között, akkor a diffúzió révén az oldószer és az oldat elkeveredne, és az eredetinél hígabb, homogén oldat jönne létre.
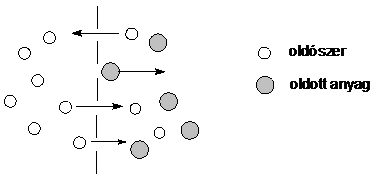
31. ábra. A féligáteresztö membrán
Jelen esetben azonban csak korlátozott mértékü koncentrációkiegyenlítödés valósulhat meg, mivel a membrán csak az oldószermolekulák részére átjárható, s így csak az oldat hígulását teszi lehetövé. Ez a folyamat folyamatosan lassul, mivel az oldószer beáramlása következtében a folyadékszint emelkedik, s az oldatra egyre nagyobb hidrosztatikus nyomás nehezedik, amely az oldószert visszajuttatni igyekszik a membránon keresztül. Ez végsö soron arra vezet, hogy az oldószer be- és kiáramlásának sebessége egyenlövé válik. Az így kialakuló állapotot ozmotikus egyensúlynak, az ahhoz vezetö áramlási jelenséget pedig ozmózisnak hívjuk. Azt a hidrosztatikus nyomást, amelynél az említett egyensúly bekövetkezik az ún. ozmózis nyomás mértékének tekintjük.

32. ábra. Az ozmózis és az ozmózisnyomás
Az oldószer és az oldat között kialakuló folyadékszint-különbség (h) és a folyadék sürüségének mérése (r) lehetövé teszi az ozmózisnyomás (p) meghatározását, mert az ozmózisnyomás egyenlö a folyadékszint-különbségnek megfelelö folyadékoszlop hidrosztatikai nyomásával:
p = h ˇr ˇ a,
ahol a = a nehézségi gyorsulás.
Híg oldatok esetén az ozmózisnyomás - a tenzió- és fagyáspontcsökkenéshez és a forráspont-emelkedéshez hasonlóan - kolligatív tulajdonság, tehát független az intakt kémiai részecskék minöségétöl, de függ azok koncentrációjától. Ha az oldat koncentrációja igen kicsi, felírható az ozmózisnyomásra a van't Hoff-féle törvény, amely nagyon hasonlít az általános gáztörvényre:
p ˇ V = i ˇ n ˇ R ˇ T
ahol p = az ozmózisnyomás (Pa),
R = egyetemes gázállandó (8.314 Jmol-1K-1),
V = az oldat térfogata (m3),
T = hömérséklet (K),
n = az oldott vegyület anyagmennyisége (mol),
Ha az oldott anyag mol/m3 egységben kifejezett koncentrációját "c"-vel jelöljük, a törvény az alábbi formában is leírható:
p = c ˇ R ˇ T.
Mivel az ozmózisnyomás a fagyáspontcsökkenéshez és a forráspont-emelkedéshez hasonlóan az oldat kolligatív tulajdonsága, ezért az ozmózisnyomás csak az oldatban lévö molekulák számától függ, és független az oldott anyag minöségétöl. Az ozmózisnyomás még viszonylag híg oldatoknál is nagy pontossággal mérhetö, ami a viszonylag nagyméretü molekulák molekulatömegének meghatározását is lehetövé teszi.
Az elektrolitok és a nem
elektrolitok azonos koncentrációjú oldatában az ozmózisnyomás,
fagyáspontcsökkenés és forráspont-emelkedés eltérö. Pl.
Az oldat felett az ozmózisnyomásnál nagyobb nyomást alkalmazva az ozmózis iránya megfordítható. Ilyenkor több oldószer-molekula távozik az oldatból, mint amennyi ugyanannyi idö alatt az oldószerfázisból az oldatba jut. E jelenséget fordított ozmózisnak nevezzük, és a gyakorlatban különbözö anyagok elválasztására, többek között só mentesítésre használjuk. Ha az oldott sókat tartalmazó vizes oldat felett az ozmózisnyomásnál nagyobbra növeljük a nyomást, akkor megfelelö féligáteresztö membrán használatával az oldatból ionmentes víz nyerhetö, hisz a membrán az ionokat visszatartja.
Az ozmózis biológiai jelentösége igen nagy, hisz az élölények szervezetében található sejtmembránok féligáteresztö hártyaként viselkednek. A sejtekben az oldott molekulák, és ionok koncentrációjának megfelelö ozmózisnyomása van. A szervezetben a sejten belül és a sejten kívüli térben azonos ozmózisnyomású oldatok találhatók. Az emberi szervezet sejtjeinek ozmózisnyomása 0,67 MPa, ami a 0,9%-os ill. 0,15M NaCl oldat ozmózisnyomásának felel meg. Az ezzel azonos ozmózisnyomású oldatokat izo-ozmotikus vagy izotóniás oldatoknak hívjuk. Ha az ozmózisnyomás ennél nagyobb, akkor hipertóniás, ha ennél kisebb, hipotóniás oldatról beszélünk. Ha a sejteket hipotóniás oldatba vagy vízbe tesszük, akkor a sejthártyán keresztül víz áramlik a sejt belsejébe, a sejtek megduzzadnak és akkora lesz a belsö nyomás, hogy a sejtmembrán megreped, és a sejt belsejében lévö oldat kifolyik (vörösvértestek esetén a fenti folyamatot hemolízisnek hívjuk). Ha a sejteket hipertóniás oldatba helyezzük, akkor a sejt belsejéböl víz áramlik az oldat felé, melynek következtében a sejtek zsugorodnak. Az izotóniás oldatoknak nagy jelentöségük van a gyógyászat területén, hisz a különbözö gyógyszereknek, injekcióknak és az infúzióknak sok estben izotóniás oldat az oldószere.
Folyadékelegyek göznyomása
A forráspont-emelkedés jelenségének tárgyalásánál említettük, hogy az oldatok fölötti göztérben az oldószer göznyomása kisebb, mint a tiszta oldószeré. Ha az oldott anyag nem illékony, akkor ez a tény az oldat forráspont emelkedése formájában nyilvánul meg. Folyadékot folyadékban oldva, (folyadékelegy) mind az
oldószer, mind az oldott anyag illékony, tehát mindkettönek a parciális nyomása kisebb lesz az oldat feletti göztérben, mintha bármelyik komponens tiszta állapotban lenne jelen. A Raoult-törvény szerint:
pB = xBpBş
ahol pB az egyik komponens parciális göznyomása,
xB a komponens móltörtje,
pB ş a komponens göznyomása tiszta állapotban.
Az ideális folyadékelegyek göznyomása a komponensek parciális nyomásainak összege ( ha az két komponensü)
p = pA pB xApA ş xBpB ş pi
azaz a folyadékelegy göznyomásgörbéje a folyadék összetétel függvényében lineáris. A gyakorlatban ideális elegyekkel ritkán találkozunk, általában kémiailag igen hasonló komponensek elegyei (például a benzol-toluol elegy) viselkednek ideális elegyként.
A reális folyadékelegyek göznyomása eltér a Raoult-törvény alapján számítottól, a folyadékelegy göznyomásgörbéje nem lineáris, attól pozitiv, vagy negativ irányban eltér.
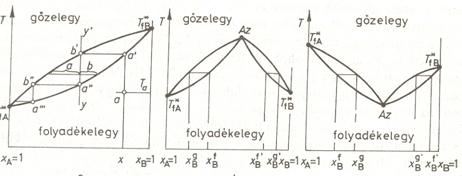
A göz összetétele mindig eltér ideális elegyek esetében a folyadék összetételétöl. Ha az összes göznyomásnak az oldat koncentrációjától való függését ábrázoló görbét likviduszgörbének nevezzük, ez mindig egyenes (27.ábra). Ha összes göznyomásnak a göz összetételétöl való függését ábrázoljuk, akkor ez a vapor görbe, amely ideális elegy esetén sem lehet egyenes. Ennél sokkal jobban használhatók, ha állandó nyomáson ábrázoljuk, akkor hasonló, de eltérö irányú görbéket kapunk és ezeket a folyadékelegy forráspontjának az összetételtöl való függésére.
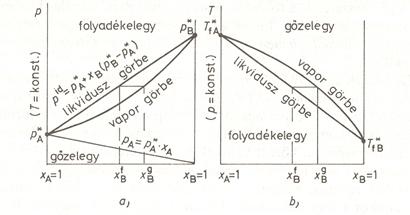
33. ábra. Kétkomponensü folyadékelegyek vapor és likviduszgörbéi állandó hömérsékleten (a - göznyomás diagramm) és állandó nyomáson (b - forráspont diagramm)
Mivel a göz összetétele a folyadék összetételétöl eltér, forralás közben mindkét fázis összetétele változik. Ennek az a következménye, hogy a folyadék elegy forráspontja nem állandó, hanem az összetételtöl függöen folyamatosan változik, nö vagy csökken. Forralás közben az elegy illékonyabb alkotórésze kerül nagyobb mennyiségben a göztérbe, így a visszamaradó folyadék a kevésbé illékony, tehát a nagyobb forráspontú alkotóban lesz gazdagabb. A folyadékelegy sem viselkedik ideálisan, így a likviduszgörbe sem lesz egyenes, hanem görbe.
a b c
34. ábra. Forráspontgörbék különbözö típusai [ a) normál, b) és
c) azetropos elegyeknél ]
A 34. ábra mutatja, hogy a 96 % etilakohol-víz elegynek minimális (c), a HCl-H2O elegynek 20,24 % HCl koncentrációnál maximális forráspontú elegye alakul ki (b). Az azeotropos összetételnél a folyadék és a gözfázis összetétele állandó és ezek desztillációval nem választhatók szét. (Az azetropos összetétel a nyomástól azonban függ. )
Folyadékelegyek párolgása során a gözösszetétel mindig eltér a folyadék összetételtöl; és az illékonyabb komponens koncentrációja a göztérben mindig nagyobb, mint a vele egyensúlyban, lévö folyadékfázisban , Konovalov I. törvénye.
Míg Konovalov II. törvénye szerint az azeotróp elegyek összetétele a párolgás során nem változik.
A nem azeotropos elegyek szétválasztása desztillációval történik.
Igen sok (föleg szerves) vegyület már a forráspontjának elérése elött bomlik. Ha bomlás nem is következik be, a magas forráspontú folyadékok desztillációja sok energiát igényel. Ilyen esetekben azt a tényt használják ki, hogy a forrás akkor következik be, ha a folyadék göznyomása eléri a külsö nyomást, tehát a folyadékra ható nyomás csökkentésével a forráspont is csökken. Ezt az eljárást nevezik vákuumdesztillációnak.
Ha az egyik komponens nagy göznyomású, de kis molekulatömegü például víz akkor a gözben feldúsul a másik komponens, melynek molekulatömege nagy, de kicsi a göznyomása. Ezt az eljárást vízgözdesztillációnak nevezik. Általában nagy molekulatömegü, magas forráspontú szerves folyadékokat kevernek vízzel, (folyamatosan vízgözt vezetnek bele), így a szerves folyadék forráspontjánál lényegesen alacsonyabb hömérsékleten lehet a desztillációt elvégezni.
Az adszorpció
A felületi rétegek számos tulajdonsága eltér a fázisok belsejétöl (ilyen például a felületi feszültség jelensége). Ha az egységnyi tömeg- anyag felülete, az úgynevezett fajlagos felület igen nagy (m2/g nagyságrendü), akkor az ilyen anyag speciális tulajdonságokkal rendelkezik. A felületen elhelyezkedö részecskék eröterét (van der Waals féle erök, H-hid) nem kötik le a többi részecskék minden oldalról, így az a szomszéd fázisra irányul, amelynek a felülethez közeli részében koncentrációnövekedés lép fel. Ez a jelenség az adszorpció. Természetesen a felületi eröhatások akkor érvényesülnek a legjobban, ha a szomszédos fázis gázhalmazállapotú. A nagy fajlagos felületü szilárd anyagot adszorbensnek, a felületén megkötött anyagot adszorptivumnak nevezzük.
Állandó hömérsékleten az egységnyi tömegü adszorbens által adszorbeált
anyagmennyiség összefüggését a gázfázis nyomásával, vagy az adszorptivum koncentrációjával, adszorpciós izotermának nevezik. Nagyobb nyomásokon, vagy nagyobb adszorptivum-koncentrációnál az adszorbens felülete telítödik. A hömérséklet növelésével az adszorbeált mennyiség csökken, mert a gázok adszorpciója szilárd felületen mindig höfelszabadulással jár (adszorpciós hö).
Az adszorbeált anyag mennyisége és az adszorptivum nyomása közötti tapasztalati összefüggést a Langmuir-féle adszorpciós izoterma írja le:
a = a'p / (p + b)
ahol b az anyagi minöségétöl függö állandó.
Az adszorpciós izotermák gyakran eltérö alakúak, mint a 29. ábrán feltüntetettek, mert az adszorpciós folyamatot sok tényezö (az adszorbens fajlagos felülete, a felületi pórusok száma és mérete, az adszorptivum és az adszorbens közötti kölcsönhatások milyensége befolyásolja).
Ha a felületen az adszorptivum kémiailag kötödik, ezt nevezik kemiszorpciónak. A legtöbb adszorpciós izoterma telítési görbe típusú, vagyis az adszorbens és adszorptívum között dinamikus egyensúly alakul ki. Az adszorpciós izoterma lakjából az adszorpciós erök természetére következtethetünk. Az I. típusú fizikai adszorpcióra illetve a kemiszorpcióra jellemzö. Ha kapilláris kondenzáció lép fel, akkor az izotermák II. vagy IV.. típusúak.
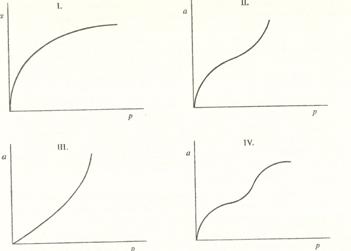
35. ábra. Adszorpciós izotermák
Kolloid rendszerek
A részecskeméret szerint a többkomponensü anyagi halmazokat három nagy csoportba oszthatjuk fel. A heterogén rendszerekben a részecskék mérete nagyobb 500 nm-nél, így azok fénymikroszkóppal vagy szabad szemmel felismerhetök. A homogén rendszereket alkotó komponensek kisebbek 1 nm-nél, mikroszkóppal nem különböztethetök meg, ilyenek pl. az oldatok.
A homogén és heterogén rendszereken kívül léteznek ún. mikroheterogén vagy ismertebb nevükön kolloid rendszerek is, melyekben a részecskék mérete 1-500 nm közé esik (kolloid részecskék). A mikroheterogén rendszereknél a részecskék a molekuláris diszperzitású részecskékhez hasonlóan sem szabad szemmel, sem közönséges fénymikroszkóppal nem különböztethetök meg egymástól, ultramikroszkóppal vagy nagyfelbontású fénymikroszkóppal azonban már igen. Az összetevök látszólag homogén elegyet alkotnak, a részecskék mérete azonban nagyobb a valódi oldatokat alkotó részecskéknél. Az ilyen anyagi rendszerek a kolloidok, melyek esetében a valódi oldatoktól való megkülönböztetés miatt nem oldószerröl és oldott anyagról, hanem diszpergáló fázisról és diszpergált anyagról beszélünk. Mivel a kolloid részecskéknek igen nagy fajlagos felületük van, a mikroheterogén rendszerek különleges tulajdonságokkal rendelkeznek, amelyek elsösorban a felületi jelenségekben nyilvánulnak meg.
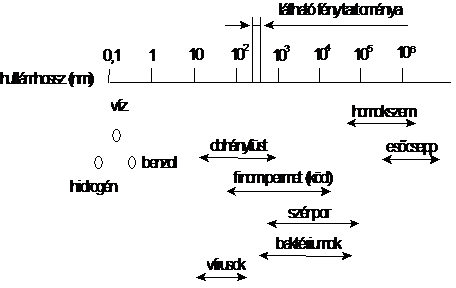
36. ábra. Különféle kémiai és biológiai anyagok részecskéinek mérete
A kolloidok tulajdonságai
Egy kolloid rendszer állapotát nagymértékben a részecskék mérete határozza meg. A részecskeméret alapján a kolloidok közé sorolható a füst, a köd és sok biológiailag fontos makromolekula: fehérjék, DNS, RNS vagy számos poliszacharid vizes oldata.
A valódi oldatoktól való eltérés a részecskék méretének, tömegének és nagy fajlagos felületének a következménye. A kolloid rendszeren átbocsátott fény a részecskék mérete miatt (1-500 nm) szóródik, míg az oldaton a fényszóródás nélkül halad át. A kolloidok fényszórását Tyndall-jelenségnek hívjuk. A kolloid részecskék viszonylagos nagy tömege és mérete miatt a gravitáció hatására a mérettöl függöen, különbözö ülepedési sebességgel ülepednek. Centrifugában az ülepedés sebessége fokozható; a koncentráció gradiens idöbeli változásának mérése alkalmas a kolloid részecskék méretének meghatározására.
Amint már említésre került, a kolloid részecskék egyik jellemzö tulajdonsága a nagy fajlagos felület. Ennek következtében a kolloidok adszorpciós készsége jelentös. A kolloid részecskék a nagy felületi energia miatt felületük csökkentésére törekszenek, ezért a kolloid rendszerek aggregációval könnyen átalakulnak vagy átalakíthatók heterogén rendszerré.
A kolloidok elöállítása és felosztása
A kolloid rendszerek mind homogén, mind heterogén rendszerekböl elöállíthatók: a homogén rendszerekböl a kisméretü molekulák aggregációjával, a heterogén rendszerböl a viszonylag nagyméretü részecskék diszpergálásával jönnek létre.
Kolloidok típusa
Fluid (nem koherens) rendszerek Szerkezettel rendelkezö (koherens) rendszerek
folyékony halmazállapotú: szilárd vázban van kolloid méretü
![]() diszperz rendszerek üreg:
amely gáz illetve folyadék
diszperz rendszerek üreg:
amely gáz illetve folyadék
asszociációs kolloidok
makromolekulás kolloidok
A különbözö makromolekulák vizes oldata szinte mindig kolloid oldatnak tekinthetö (pl. fehérje, keményítö: az anyag molekula mérete akkora, hogy csak kolloid oldatot tud kialakítani).
A kolloid részecskék aggregációs készsége, valamint ülepedése miatt a kolloid rendszerek általában nem stabilak. A viszonylagos stabilitás függ a kolloidok összetételétöl és sok esetben az adalékanyagok jelenlététöl. Ez utóbbiakat emulzifikáló anyagoknak is nevezzük. Az adalékanyagok a kolloid részecske felületén védöréteget képezve megakadályozzák asszociátumok kialakulását és fázisok elkülönülését.
13. táblázat: Diszperziós kolloidok típusai
|
Diszpergáló fázis |
Diszpergált anyag |
A kolloid típusa |
Példák |
|
folyadék gáz szilárd |
gáz folyadék szilárd folyadék szilárd gáz folyadék szilárd |
hab emulzió gél, szol, szuszpenzió aeroszol aeroszol szilárd hab szilárd emulzió vagy gél szilárd szól |
sörhab, tejszínhab tej, majonéz, arckrém zselatin köd, spray füst poliuretánhab sajt zárványok |
A diszperziós kolloidok egyik jellemzöje, hogy a diszpergált részecskéknek nagy a fajlagos felülete, ezért a felületi energia a rendszer összes energiatartalmának viszonylag nagy hányadát teszi ki. Így diszperziós kolloidok ezért termodinamikailag nem stabilak, a részecskék könnyen aggregálódnak ( koagulálnak), ezáltal csökken a felületi energiájuk és a kolloid állapot megszünik. Ezzel szemben a makromolekulás és asszociációs kolloidok - megfelelö körülmények között -, stabil kolloid rendszert, "stabil kolloid oldatot" alkotnak.
A hidrofil és hidrofób kolloidok
Ha a diszpergáló fázis víz, akkor a kolloid rendszereket hidrofil és hidrofób kolloidokra oszthatjuk.
A hidrofil kolloidoknál a diszpergált részecskék és a vízmolekulák közt erös kölcsönhatások jönnek létre. Ezek a kolloidok csak a részecskék méretében különböznek a valódi vizes oldatoktól. A diszpergált anyag és az oldószer erös kölcsönhatása miatt a hidrofil kolloidok - mint pl. a fehérjék vizes oldata - viszonylag stabilak. A kolloid részecskék a felületen oldószer molekulákat, vagy felületén töltéssel rendelkezö ionokat köt meg esetleg kettös ionrétegböl álló diffúz réteg veszi körül, ami megakadályozza a részecskék egymással történö ütközését és így azok aggregációját (31. ábra)
A hidrofil kolloidokban a diszpergált részecskék vízmolekulákat kötnek meg felületükön, miáltal a részecskék aggregációs készsége csökken. Erös elektrolitok a bennük levö pozitív és negatív ionok hidratációja miatt nagyszámú vízmolekulát vonnak el a kolloid felületéröl, melynek következtében a részecskék aggregációs készsége megnövekszik, és az aggregált részecskék gravitáció hatására leülepednek.
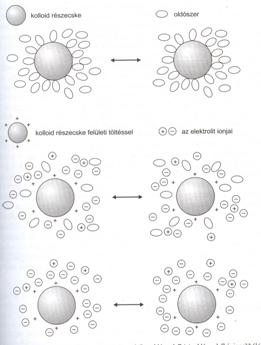
37. ábra. Kolloidok stabilizálása
Fentieken alapul a fehérjefrakciók elválasztása az ún. kisózással történö kicsapáskor. A kolloidok erös elektrolitokkal történö kicsapása reverzíbilis; a csapadékos szuszpenziót vízzel szemben dializálva az ionok a rendszerböl eltávoznak, és a kicsapott részecskék ismét diszpergálódnak a vizes oldatban.
A hidrofób kolloidokban nem jön létre kölcsönhatás a diszpergált részecskék és a víz között, ezért a hidrofób kolloidok nem stabilak; a diszpergált anyag asszociátumokat képezve könnyen elválik a diszpergált fázistól. Hidrofób kolloidok képzödnek pl. esetenként túltelített oldatok kristályosodásakor. Gyors kristályosodáskor nagyon sok kristálygóc keletkezik, melyek kolloid méretü részecskékké növekednek.
Mint általában az elektrolitokra, a kolloid rendszerekre is jellemzö az elektroneutralitás (a pozitív és negatív töltések száma azonos), de a töltések eloszlása az egyes kolloid részecskéken belül nem azonos, ezért elektromos erötérben a részecskék töltésüktöl függöen vándorolnak. A pozitív töltésü kolloid részecskéket negatív töltésü anionok veszik körül. A negatív töltésü réteg vastagsága az anion méretétöl és töltésétöl függ. Ha az anionok elég közel kerülnek a kolloid részecskékhez, azok töltését semlegesítik, s így erösödik az aggregációra való hajlam és a kolloid koagulál, olyan nagyok lesznek, hogy kiválnak az oldatból.
A kolloidok öregedésének azt a lassu folyamatot nevezik, melynek során a Brown-féle mozgás miatt egymással ütközô részecskék összetapadnak, koagulálnak, és a kolloid oldat szemmel, vagy optikai mikroszkóppal látható részecskéket tartalmazó durva diszperz rendszerré alakul.
Amikor vizes oldatban olyan molekulák vannak, melyek poláros és apoláros résszel is rendelkeznek (amfipatikus molekulák), azok a koncentrációjuktól függöen vagy valódi oldatot, vagy kolloid részecskéket képeznek. Az ilyen molekulák ugy alkotnak csoportokat, hogy a részecske belseje felé apoláros végeiket, a víz felé poláros végeiket fordítják. (Például a szappan-oldat). Az ilyen kolloid részecskéket micelláknak, és azt a kolloid rendszert, melynek a diszperz fázisa micellákból áll, asszociációs kolloidoknak nevezik. Ha az amfipatikus molekulák koncentrációja túl nagy, a micellák összetapadnak, kiválnak az oldatból, megszünik a kolloid rendszer. Ezt a koncentrációt nevezik kritikus micella koncentrációnak (CMC).
Az asszociációs kolloidok olyan molekulákból jönnek létre, amelyek hidrofil és hidrofób csoportokat is tartalmaznak. Ilyenek pl. a hosszú hidrofób szénhidrogénláncot és karboxilcsoportot is tartalmazó zsírsavak (palmitinsav, sztearinsav), melyek sói a szappanok, valamint a detergensek és a foszfo-lipidek. Az oldás során a hidrofób molekularészek kölcsönhatásával több molekulából álló asszociátum jön létre, melyet micellának hívunk. A kialakuló micellák szerkezetét a 32. ábra mutatja.
A micellában a hidrofób molekularészek a micella belseje, a hidrofil molekularészek a víz felé mutatnak. A micellaképzödésen alapul a szappanok és más detergensek tisztítóhatása. Mivel a zsíros-olajos szennyezödések hidrofób jellegükböl adódóan a micella belsö részén helyezkednek el, a micella külsö részén lévö hidrofil csoportok pedig kölcsönhatást alakítanak ki a vízzel, a hidrofób szennyezödés detergens jelenlétében víz oldhatóvá válik.

38. ábra. Micellaképzödés vizes oldatban
Az amfipatikus molekulák a víz felületi feszültségét csökkentik. A felületi feszültséget csökkentö anyagokat tenzideknek nevezzük. Megkülönböztetünk anionaktiv tenzideket (pl. szappanok), kationaktiv tenzideket (pl. piridinium-halogenidek, és nemionos tenzideket (pl. polialkohol-szárnazékok). A tenzideket gyakran használjuk kolloid oldatok létrehozására is. Funkciójuk szerint az emulziókat stabilizáló tenzideket emulgeátoroknak, a szuszpenziókat stabilizáló tenzideket szuszpendáló szereknek, a mosószereket detergenseknek nevezzük.
A tenzidek legnagyobb része - föleg a nemionos tenzide - olyan nagy molekulájú anyagok, melyek kémiai összetétele nem teljesen egységes, kémiai neve nem adható meg, képlete nem irható fel. A ma használt többezer tenzid közötti eligazodást megkönnyíti a tenzidek úgynevezett HLB értéke (Hydrophil-Lyphopil-Balance), amely felvilágosítást az az adott tenzid felhasználhatóságára. (14. táblázat).
14. táblázat. Emulgeátorok és jellemzöik.
__________ ______ ____ _____ _______ ______ _____________
HLB érték Felhasználási terület
__________ ______ ____ _____ _______ ______ _____________
4-6 V/O emulgeátor
7-9 Felületi feszültséget csökkentö, nedvesitöszer
8-18 O/V emulgeátor
13-15 Mosóaktiv anyag (detergens)
10-18 Szolubilizáló anyag
V/O típusú (viz az olajban) emulziókban poláros anyagot emulgeálunk apoláros oldószerben, az O/V típusú (olaj a vízben) emulziókban apoláros anyagot poláros oldószerben emulgeálunk.
Találat: 7353