| kategória | ||||||||||
|
|
||||||||||
|
|
||
A szén-szén hármas kötést tartalmazó telítetlen szénhidrogéneket alkinoknak vagy legegyszerübb képviselöjük az acetilén triviális neve alapján acetilén-szénhidrogéneknek is szokás nevezni.
Az acetilén és származékai a természetben nem vagy igen ritkán fordulnak elö. Szintetikus úton azonban jelentös mennyiségben állítanak elö acetilént, föként az alkánok tárgyalása során is említett telített szénhidrogénekböl kiinduló höbontással. Az acetilén nagyfokú reakciókészségének és változatos átalakítási lehetöségeinek köszönhetöen a múlt század derekán a legfontosabb vegyipari alapanyaggá vált. N 141c22b apjainkban már jelentösége csökkent, szerepét az olcsóbb etén vette át.
A normál szénláncú alkinok nevét az azonos szénatomszámú telített szénhidrogének nevéböl vezetjük le úgy, hogy az -án végzödést -in végzödésre cseréljük. Ennek megfelelöen az acetilén pontos elnevezése etin. Ha a vegyület több hármas kötést tartalmaz, akkor az -(a)diin, -(a)triin stb. végzödést használjuk. A számozást úgy választjuk meg, hogy a hármas kötés helyét a lehetö legkisebb helyzetszám jelezze.
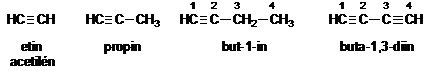
Kettös és hármas kötés egyidejü jelenlétét -énin, -adienin, -éndiin stb. végzödéssel jelezzük.
Ha választani lehet, akkor a kettös kötés kapja a kisebb helyzetszámot.
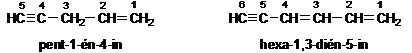
Elágazó szénlánc esetén a hármas kötést tartalmazó láncot tekintjük föláncnak. Ha a vegyület több kettös és hármas kötést is tartalmaz, akkor a több kettös kötést tartalmazó lánc lesz a fölánc.
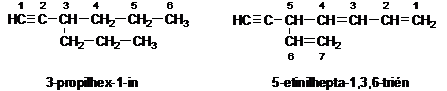
Az alapvegyületekböl levezethetö csoportok nevét úgy képezzük, hogy az alapvegyület nevéhez -il, -diil stb. végzödést kapcsolunk.
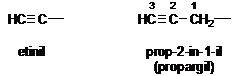
Az alkinok legegyszerübb képviselöjében, az acetilénben a szénatomok sp hibridállapotúak. A hibridpályák révén a szénatomok két-két s-kötést létesítenek, melyek lineárisak. A szénatomok nem-hibridizált pz és py pályái páronként az egymásra meröleges síkok mentén átfedésbe kerülnek és létrejön a két p-kötés. Az így kialakult szén-szén hármas kötés hossza jelentösen kisebb, mint a kettös kötésé, például az etinben 121,2 pm.

ALKINOK STABILITÁSA
Az acetilén nagy energiatartalmú instabil vegyület, amire a hidrogénezési hö nagyságából is következtethetünk. Az acetilén hidrogénezésekor 311 kJ mol-1 energia szabadul fel, ami több mint az etén telítésekor felszabaduló reakcióhö (136,5 kJ mol-1) kétszerese.
ALKINOK ELŐÁLLÍTÁSA
Ipari módszerek
Gyakorlati szempontból legfontosabb az acetilén elöállítása. Korábban kalcium-karbid vizes hidrolízisével állították elö. Kalcium-karbidot egyébként szénböl és kalcium-oxidból ívfény hömérsékletén nyerik.

Ez a módszer nagyon energiaigényes és környezetszennyezö, ezért iparilag az acetilént napjainkban a metán höbontásával állítják elö (l. ???. old.).
Laboratóriumi módszerek
Hármas kötés kialakítása dehidrohalogénezéssel
Az olefinekböl elöállítható vicinális dihalogénszármazékokból alkoholos KOH-val magas hömérsékleten alkineket nyerünk. A módszer hátránya, hogy keverékek képzödhetnek.
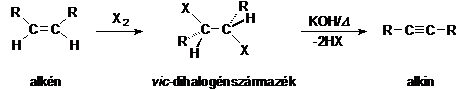
Alkinok elöállítása szénlánchosszabbítással
Az etinilezési eljárás acetilénböl kiindulva szubsztituált acetilénszármazékokat eredményez (l. ???. old.).
ALKINOK FIZIKAI TULAJDONSÁGAI
Az alkinok homológ sorának általános képlete CnH2n-2. Az alkinok fizikai tulajdonságai hasonló módon változnak a szénatomszám függvényében, mint az alkánok és alkének tulajdonságai. A monoalkinok C4-ig gáz halmazállapotúak, C5-C16-ig folyékonyak és C17-töl kristályos vegyületek.
ALKINOK KÉMIAI TULAJDONSÁGAI
Az acetilén-szénhidrogének nagy energiájú telítetlen vegyületek, ezért az olefinekhez hasonlóan hajlamosak addíciós reakciókra. Az etinnek bizonyos reakciói azonban eltéröek az eddig tárgyalt szénhidrogének reakcióitól, ami az sp hibridállapotú szénatom nagyobb s-karakterére, így nagyobb elektronegativitására, azaz e vegyület CH-savasságra vezethetö vissza.
ADDICIÓS REAKCIÓK
Hidrogén addíció
Alkinok katalitikus hidrogénezése két lépésben, alkénen keresztül telített vegyületet eredményez.
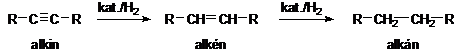
A reakció megállítható alkén fázisban, ha megfelelöen csökkentett aktivitású katalizátort alkalmazunk. A gyakorlatban az ún. Lindlar-katalizátort használják, ami Pb(OAc)2-vel mérgezett Pd/CaCO3 katalizátor. Ezzel a módszerrel difenilacetilénböl a cisz-difeniletént (cisz-stilbén) nyerhetünk.
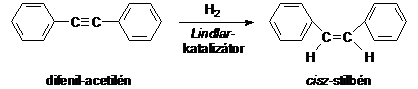
A hidrogénaddíció cseppfolyós ammóniában oldott fémnátriummal (amely elektrondonor szerepét tölti be) is végrehajtható. Ebben az esetben a katalitikus hidrogénezéstöl eltéröen nem cisz, hanem transz addíció játszódik le.

Hidrogén-halogenid addíció
Az alkinok HX-addíciós reakciói - hasonlóan az olefinekhez - ionos vagy gyökös mechanizmus szerint mehetnek végbe, és a képzödö termék szerkezetét hasonló módon befolyásolják a közbensötermék (karbokation vagy gyök) stabilitási viszonyai. A reakcióban elöször szubsztituált olefin képzödik, ami tovább reagálhat újabb HX-molekulával. Például az acetilén HCl-addíciójában három termék is keletkezhet.
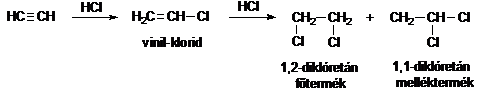
Az acetilén addíciós reakcióit szokás vinilezési reakcióknak is nevezni.
Acetilén hidratálása
Az olefinek savkatalizált vízaddíciója, mint korábban láttuk, alkoholokat eredményez. Az acetilén vízaddíciója során viszont egy oxovegyületet, nevezetesen az acetaldehidet lehet izolálni. A reakció során ugyan képzödik vinil-alkohol, de az azonnal izomerizál a termodinamikailag stabilisabb oxovegyületté. Ezt a reverzibilis átalakulást keto-enol tautomériának nevezzük, és okait részletesebben a késöbbiekben tárgyaljuk.

Egyéb vinilezési reakciók
Alkalmas reakciókörülményeket választva az acetilénre egyéb HX-típusú vegyület is addícionálódhat, és az így nyert vinilszármazékok hasonlóan a vinil-kloridhoz fontos müanyagalapanyagok (l. ???. old.). Ily módon karbonsavakkal vinil-észterek, alkoholokkal vinil-éterek és hidrogén-cianiddal akril-nitril állítható elö.
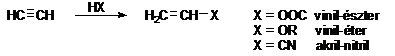
Halogénaddíció
Az alkinok halogénekkel hevesen reagálnak. Egy mol bróm addíciója esetén nem tapasztaljuk az olefineknél észlelt sztereoszelektív transz addíciót, ugyanis a cisz és transz olefin keveréke képzödik. Újabb molekula bróm hatására tetrabróm-származékot kapunk.
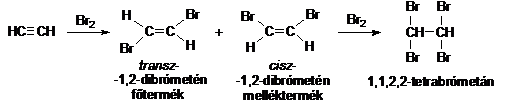
Etinilezési reakciók
A szerves vegyületek sav-bázis tulajdonságainak tárgyalásánál már utaltunk rá (l. ???. old.), hogy a különbözö hibridállapotú szénatomok eltérö módon stabilizálják az aniont, így az acetilén, etén és etán deprotonálásával képzödö anionok közül az acetilidanion a leggyengébb bázis. Ami azt is jelenti, hogy az említett három szénhidrogén közül az acetilén a legerösebb (C-H) sav, mivel az sp hibridállapotú szénatomnak az elektronegativitása a legnagyobb. A savi erösséget kifejezö, vízre vonatkoztatott pKa értékeket az alábbiakban tüntetjük fel (l. ???. old.).
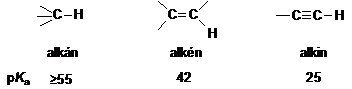
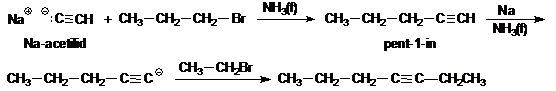
Látható, hogy még az acetilén is nagyon gyenge sav, ezért fémekkel alkotott sóiból, a karbidokból még a víz is felszabadítja, mint azt a kálcium-karbidból történö elöállítása során már láttuk. Az acetilén CH-savasságán alapul, hogy nukleofil szubsztitúciós reakciókban, mint C-nukleofil partner vehet részt (l. alkil-halogenidek és oxovegyületek reakcióit). Ennek során új C-C kötés kialakításával etinil csoportot építhetünk be a molekulákba. Példaként a szubsztituált acetilénszármazékok szintézisére is alkalmas reakciósort mutatjuk be.
Dimerizációs és trimerizációs reakciók
Az acetilén dimerizációval vinil-acetilénné alakul.

A benzol elsö szerkezetbizonyító szintézisét jelentette az acetilén hö hatására bekövetkezö trimerizációja (Berthelot, 1866).
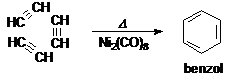
FONTOSABB ALKINOK
Acetilén
Az alkinok legfontosabb képviselöje számos vegyipari eljárás kiindulási anyaga. A vinilezési és etinilezési reakciók fontos müanyagok gyártásához szolgáltatják az alapanyagot (pl. vinil-klorid, vinil-éter). Az említetteken kívül jelentös a butadién acetilénböl megvalósuló szintézise (l. ???. old.). A gyógyszeripar leghatékonyabb fogamzásgátló szerei is etinil csoportot tartalmazó szteránvázas vegyületek.
Találat: 2944