| kategória | ||||||||||
|
|
||||||||||
|
|
||
HOMOGÉNKATALITIKUS AMINOKARBONILEZÉS: ÚJ MÓDSZER KIDOLGOZÁSA N-ferrocenoil-aminosav-észterek, FERROCÉNGLIOXAMIDOK ÉS DISZUBSZTITUÁLT FERROCÉNSZÁRMAZÉKOK SZINTÉZISÉRE
1.2. A ferrocénkarbonsavamidok tulajdonságai, felhasználásuk
1.2.1. Molekula- és ionreceptorok
1.3. Ferrocén-amidok előállítása
1.4. N-Ferrocenoil-aminosavak és -peptidek előállítása
1.5. Palládium-katalizált reakciók
1.5.1. A jód-ferrocén és a dijód-ferrocén palládium-katalizált reakciói
2. Az eredmények bemutatása és értékelése
2.2. Jód-ferrocén aminokarbonilezése aminosav-észterek jelenlétében
2.3. 1,1'-dijód-ferrocén aminokarbonilezése különböző szekunder aminok jelenlétében
2.5. 1,n'-ferrocéndikarboxamidok szerkezetének vizsgálata
2.6. 1,1'-dijód-ferrocén aminokarbonilezése aminosav-észterek jelenlétében
2.7. Heterodiszubsztituált 1,1'-ferrocén származékok előállításának egy további lehetősége
3.1. A kísérleti munka során felhasznált anyagok előállítása, minősége
3.1.1. Alapanyagok, katalizátorok és segédanyagok
3.2. A kísérletek kivitelezése, az egyes származékok kinyerése
3.2.1. Jód-ferrocén előállítása
3.2.2. 1,1'-dijód-ferrocén előállítása
3.2.3. Aminosav-metil-észterek előállítása
3.2.4. Jód-ferrocén karbonilezése aminosav-észterek jelenlétében
3.2.5. 1,1'-dijód-ferrocén aminokarbonilezése aminok jelenlétében
3.2.6. 1'-jód-ferrocénkarboxamid és 1'-jód-ferrocénglioxamid Stille-reakciója
3.2.7. 1'-benzoil-N,N-dietil-ferrocénkarboxamid (15a) előállítása
3.2.8. 1,1'-dijód-ferrocén aminokarbonilezése aminosavészterek jelenlétében
3.2.9. 1'-acetil-N-ferrocenoil-glicin-metil-észter (18) előállítása
3.3. Műszeres analitikai vizsgálati módszerek és készülékek
4. Az előállított vegyületek analitikai adatai
A ferrocénszármazékok jó stabilitásuknak és kedvező elektrokémiai tulajdonságaiknak köszönhetően gyakorlati szempontból nagy jelentőséggel bírnak. Felhasználhatóak homogénkatalitikus szintézisekben ligandumként, redox aktív molekula- és ionreceptorként, redoxkapcsolóként, vagy bioszenzorként. A ferrocénkarbonsav amid származékainak jelentőségét figyelembe véve fontos lehet egy új, egyszerű, ugyanakkor hatékony módszer kidolgozása ezen vegyületek szintézisére.
A munka célja N-ferrocenoil-aminosav-észterek, a ferrocénvázas vegyületek között újszerű ferrocénglioxamidok, valamint egyéb ferrocénszármazékok szintézise volt, a ferrocénszármazékok előállítása során eddigiekben nem alkalmazott palládium katalizált homogénkatalitikus karbonilezési eljárással.
A Pannon Egyetem Szerves Kémia Intézeti Tanszékén elkezdett jód-ferrocén karbonilezési kísérletek során új típusú ferrocénglioxamidokat szintetizáltak, ferrocénkarboxamid melléktermék keletkezése mellett.
A munka folytatásaként a szerző vizsgálta a jód-ferrocén palládium katalizált aminokarbonilezését aminosav-észterek mint nukleofil reakciópartnerek jelenlétében.
Megállapította, hogy a korábbi jód-ferrocén és szekunder aminok karbonilezési reakcióinál tapasztaltakkal ellentétben nem a hőmérséklettel, hanem a megfelelő bázis alkalmazásával lehet a reakciók szelektivitását eredményesen befolyásolni. A vizsgálatok eredményeiből meghatározta, a ferrocénglioxamidok, illetve ferrocénkarboxamidok előállításához optimális reakciókörülményeket. Bizonyította, hogy karbonilezési körülmények között a bázisként alkalmazott DBU is acilezhető.
Az 1,1'-dijód-ferrocén aminokarbonilezésének vizsgálata rámutatott, hogy a megfelelő reakciókörülmények megválasztásával 1'-jód-ferrocénkarboxamidok és -glioxamidok közepes hozammal szintetizálhatóak, melyek további homogénkatalitikus reakciókba vihetők, változatos szerkezető heterodiszubsztituált ferrocénszármazékokat eredményezve.
A
részletes kutatómunka eredményeként egyszerű és hatékony eljárás született két
különböző amidocsoportot tartalmazó 1,1'-ferrocéndikarboxamidok, illetve 1,n'-ferrocenoil-aminosav-észtereket
előállítására, melyekre rendkívül kevés példát találunk az irodalomban.
A ferrocén felfedezésével, szerkezetének tisztázásával új korszak nyílt meg a fémorganikus kémia területén. Számos eljárást dolgoztak ki a legkülönbözőbb ferrocénszármazékok szintézisére, mely egy olyan dinamikusan fejlődő vegyületcsalád megismerését jelentette, amely gyakorlati szempontból rendkívül hasznos tulajdonságokkal rendelkezik. Használják őket homogénkatalitikus szintézisekben ligandumként, redox aktív molekula- és ionreceptorként, redoxkapcsolóként, vagy bioszenzorként.
Az említett vegyületek közül az N-ferrocenoil-aminosavszármazékok biokémiai és farmakológiai szempontból is igen nagy jelentőséggel bírnak. Jól alkalmazhatóak például élő szervezetekben lejátszódó elektrontranszfer folyamatok vizsgálatára, vagy különböző molekulákra érzékeny bioszenzorként. Emellett segítségükkel bizonyos peptidek szerkezeti jellemzőiről is információt nyerhetünk.
Napjainkban a szerves molekulák szén-monoxiddal történő funkcionalizálása dinamikusan fejlődő eljárás, alkalmazása várhatóan továbbra is teret hódít a szintetikus kémia területén.
A karbonilezési folyamatok tárgykörén belül nagyszámú, igen részletes irodalom áll rendelkezésre az aminok jelenlétében lejátszódó aminokarbonilezés leírására vonatkozóan.
A kiterjedt kutatások ellenére ferrocénszármazékok ily módon történő előállítását egyedül kutatócsoportunk vizsgálta.
Az irodalmi adatok azt mutatják, hogy az aminokarbonilezés eredménye rendkívül érzékeny a reakciókörülmények változásaira, legyen az akár a kiindulási anyagkánt használt szerves molekula, az alkalmazott bázis vagy a nukleofil reagensként használt amin, de a reakció hőmérséklete, a szén-monoxid nyomás, oldószer, katalizátor mind jelentősen befolyásolják a karbonilezés kimenetelét.
A ferrocénkarbonsav amidszármazékai gyakorlati jelentőségének okán fontos lehet egy, az eddigieknél hatékonyabb és ugyanakkor egyszerűbb eljárás kidolgozása. Erre kínál lehetőséget az előbb említett, különböző nukleofil reagensek jelenlétében végrehajtott aminokarbonilezési eljárás.
Kísérleteim kiindulási vegyületeként jód-ferrocént, illetve 1,1'-dijód-ferrocént, nukleofil reakciópartnerként primer és szekunder aminokat, illetve aminosav-metil-észtereket használtam. A vizsgálataim főként arra irányultak, hogy új, hatékony eljárást dolgozzak ki ferrocénkarboxamidok és ferrocénglioxamidok előállítására. Az előállított új vegyületek elkülönítésén és karakterizálásán túlmenően egy esetben a vegyület mélyreható szerkezetvizsgálatát is elvégeztem. Továbbá egyéb homogénkatalitikus eljárások kombinációjával új ferrocénszármazékok szintézisének lehetőségét is vizsgáltam.
Ebben a fejezetben szeretném összefoglalni munkám előzményeit, irodalmi hátterét. Igyekszem bemutatni a dolgozat alapját képező ferrocénszármazékok tulajdonságait, felhasználási lehetőségeit, lehetséges előállítási módjait. Röviden áttekintem az általam használt jód-ferrocén és 1,1'-dijód-ferrocén palládium-katalizált homogénkatalitikus reakcióit. Részletesebben tárgyalom az aminokarbonilezési reakciók általános jellemzőit.
A ferrocén felfedezése, szerkezetének megismerése, karakterizálása az 1950-es évek elején a fémorganikus kémia robbanásszerű fejlődéséhez vezetett és e vegyületet a mai napig töretlen tudományos érdeklődés övezi.
Először Kaely és
Pauson számolt be egy új típusú vas-organikus vegyületről a "Nature" hasábjain
1951-ben [1] Ciklopentadienil-magnézium-bromidot reagáltattak
vas(III)-kloriddal, azzal a céllal, hogy fulvalént ![]() állítsanak
elő (1.1 egyenlet). Ehelyett egy meglepően stabil, narancssárga színű port
kaptak. A stabilitást a ciklopentadienil-anion aromás jellegének tudták be.
állítsanak
elő (1.1 egyenlet). Ehelyett egy meglepően stabil, narancssárga színű port
kaptak. A stabilitást a ciklopentadienil-anion aromás jellegének tudták be.
![]() (1.1)
(1.1)
Tőlük függetlenül Miller és munkatársai szintén "diciklopentadienil-vas"-at szintetizáltak (1.2 egyenlet).
![]() (1.2)
(1.2)
A bisz(η5-ciklopentadienil)vas valódi szerkezetét ők még nem ismerték fel. Robert Burns Woodward és Goeffrey Wilkinson következtetett először a szendvics szerkezetre [2]. Tőlük függetlenül Ernst Otto Fischer szintén erre a megállapításra jutott.[3]. Feltételezésük helyességét NMR és röntgen adatokkal igazolták.
A koordinatív kapcsolat a fématom üres d-orbitáljainak és a ciklopentadienil-gyűrűk delokalizált π-MO-jainak átfedése révén jön létre.
Kémiai tulajdonságait tekintve a ferrocén - aromás jellegénél fogva - számos aromás szénhidrogénekre jellemző reakcióba vihető. A ferrocén reakciókészségét alapvetően meghatározza az a tény, hogy a ciklopentedienil-gyűrű parciális negatív töltést hordoz, ezért a benzolszármazékokhoz képest elektrofil reagansekkel szemben nagyobb reakciókészséget mutat.
Az elektrofil szubsztitúciós reakcióban az elektrofil reakciópartner nem lehet oxidálószer, mert a Fe(II) → Fe(III) oxidációban keletkező ferricíniumion ( [Fe(Cp)2] ) elektrofilekkel nem támadható.
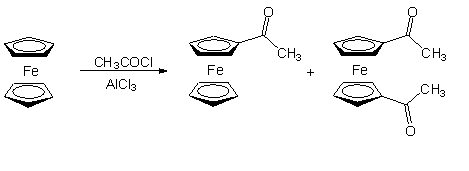
A Cp gyűrű nagy reakciókészségét mutatja, hogy Friedel-Crafts-acilezés során minden esetben termékelegyet kapunk. Például az alábbi reakcióban a monoacetil-ferrocén mellett megfigyelhető az 1,1'-diacetil-ferrocén keletkezése is [4].
A ferrocénkarbonsav amidszármazékai széles körben alkalmazott építőkövek a szupramolekuláris kémiában. Használják őket redox aktív molekula- és ionreceptorként, redox kapcsolóként, vagy bioszenzorként. Mindez a ferrocénvegyületek különleges szerkezeti és elektrokémiai tulajdonságainak köszönhető.
A ferrocénnek jól karakterizálható egy elektronos oxidációja, valamint mind a ferrocén, mind pedig a ferrocínium kation stabilitása teszi a ferrocén származékait különösen alkalmassá arra, hogy elektrokémiai szondaként számos területen alkalmazhatóak legyenek. A ferrocénszármazékok redox sajátságát a szubsztituensek erősen befolyásolják. Ha ezekhez valamilyen vendég (guest) molekula, vagy ion kapcsolódik, az változást idéz elő a ferrocén egység redox viselkedésében, ami például ciklikus-voltammetria segítségével nyomon követhető.
A dolgozat korlátait figyelembe véve csak néhány konkrét példát említek a számos felhasználási lehetőség közül.
A redox érzékeny receptorok olyan molekulák, amelyek képesek egy vendég (guest) molekula vagy ion szelektív megkötésére, amely azután nemkötő kölcsönhatásokon, és/vagy különböző kötéseken keresztül hatást fejt ki a redox központra. A hatás elektrokémiai módszerekkel (általában ciklikus voltammetriával) mérhető.
Az amidszármazékok között találhatunk kationra, anionra, vagy neutrális molekulákra érzékeny receptorokat is.
Az első csoportra kiváló példa a ferrocéndikarbonsav N,N-dialkil-amid származékai, melyek az alkáli-fémionok közül szelektíven csak a lítiumiont kötik meg az 1.4 egyenletben feltüntetett komplexek képződése révén. A komplexek kialakulását különbözőző analitikai módszerekkel (13C-NMR, CV, UV-Vis) igazolták [5].
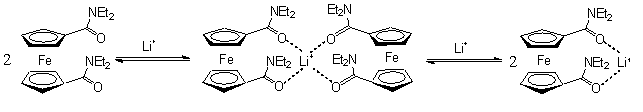
LiBF4 fokozatos adagolása az N,N-dietil-ferrocénkarboxamid oldatához a karbonil szénatom eltolódásának folyamatos növekedéséhez vezetett a 13C-NMR spektrumban, mivel a karbonil-oxigénhez koordinálódó Li+ növeli az oxigénatom elektronszívó hatását. A ciklikus-voltammogramon a LiBF4 adagolása a csúcspotenciál pozitív irányú eltolódását, illetve a csúcsáramok intenzitásának csökkenését, valamint nagyobb Li+ felesleg (>1ekv.) - mintegy 300mV-al nagyobb potenciálértéknél - egy újabb, a ferrocén-dikarboxamid/lítium=1/1 komplexhez tartozó potenciálcsúcs megjelenését eredményezte. Ugyanakkor Na+ és K+ ionok hozzáadása nem okozott detektálható változást a fenti vizsgálatok során.
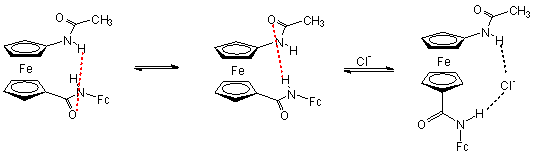
Az 1.5 egyenletben látható amidot kloridionokkal reagáltatták. Az anion hasítja a receptor molekula intramolekuláris hidrogénkötését, és egyidejűleg koordinálódik mindkét amidocsoporthoz hidrogénkötésen keresztül. A kloridion koordinációja megváltoztatja a két ciklopentadienil gyűrű elfordulásának szögét, valamint a ferrocén/ferrocínium redox pár redoxpotenciálját, így a kloridkoncentráció mérhető [6, 7].
Az Astruc és munkatársai által kifejlesztett, amidoferrocenil-alkiltiolát ligandummal módosított arany elektród (1.1 ábra) szelektíven ismeri fel a dihidrogén-foszfát aniont. A H2PO4- anion - hidrogénkötés-akceptor negatív töltésű oxigénje, illetve hidrogénkötés-donor savas OH csoportja miatt - két hidrogénkötésen keresztül is képes koordinálódni az ugyancsak kettős tulajdonságú amidocsoporttal rendelkező receptor molekulához (1.1 ábra). Más szervetlen anionokkal végzett vizsgálatok (pl. HSO4-, NO3-, Cl-, és Br-) nem okoztak jelentős változást a ciklikus voltammogramon [8].
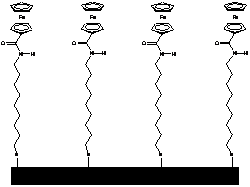
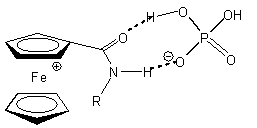
1.1 ábra Amidoferrocenil-alkiltioláttal módosított arany elektród és a H2PO4- anionnal kialakított hidrogénkötések
Ferrocéntartalmú amidopiridil receptorok 1,1'- és 1,3- regioizomerjei heterociklusos molekulákkal képeznek komplexeket komplementer hidrogénhidakon keresztül. A redoxaktív ferrocenilcsoport jelenlétének köszönhetően a komplexképződés folyamata elektrokémiai módszerekkel szintén nyomon követhető [9, 10].
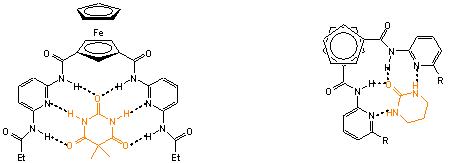
1.2 ábra Ferrocéntartalmú amidopiridil receptorok heterociklusos vegyületekkel alkotott komplexei
A bioszenzorok olyan mikró kivitelű elektrokémiai, optikai, vagy egyéb érzékelők, melyek felületére biológiailag aktív anyagot kötnek. A detektált jel függvénykapcsolatban van egy mérendő anyag mennyiségével.
A géndiagnosztika egyik kulcskérdése a DNS molekula érzékeny és egyszerű detektálásának lehetősége. A legáltalánosabban alkalmazott vizsgálati módszer, hogy egy próba DNS-t, mely a célpont DNS komplementer szekvenciájával rendelkezik, radioaktív izotóppal, például 32P-al jelölnek meg és a két DNS molekula között kialakult kapcsolat miatt detektálhatóvá válik a keresett DNS szakasz. Habár a radioizotópos nyomjelzés a jó detektálhatóság miatt széles körben elterjedt, veszélyessége, illetve a jelző izotóp rövid élettartama miatt más alternatív megoldások válhatnak jelentőssé. Az egyik lehetőség az elektrokémiai módszerrel történő detektálás. Habár a DNS közönséges körülmények között redox-inaktív, különböző módszerekkel, például ferrocenkarbonsav származékok hozzákapcsolásával aktívvá tehető (1.3 ábra). Az így kapott próba DNS által keresett DNS nemcsak hogy elektrokémiai úton jól detektálható, de mennyiségileg is meghatározható


1.3 ábra Ferrocén tartalmú próba DNS
Heller és Degani glükóz-oxidáz enzimek aminosav végeihez kapcsoltak ferrocén egységeket peptid kötéssel (1.4 ábra). Ezáltal közvetlen elektronikus kapcsolat jöhet létre egy elektród és az enzim FAD/FADH központja között, ami pusztán az enzim és az elektród között nem tud kialakulni. Azáltal, hogy a ferrocén/ferrocínium pár képes elektronokat közvetíteni az enzim és az elektród között, lehetőség nyílik az 1.4 ábrán látható enzimkatalizált reakcióban keletkező redukált állapotú FADH direkt reoxidálására. Ha az elektródra feszültséget kapcsolunk elektronvándorlás indul meg, a mérhető áram erőssége (I) függvénykapcsolatban van a glükóz koncentrációval [12].
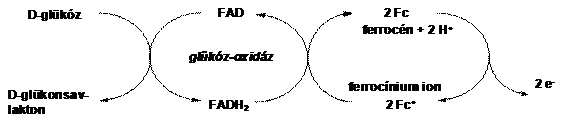
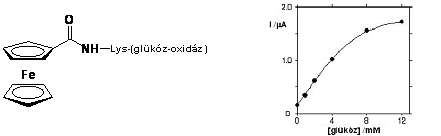
1.4 ábra Ferrocénnel módosított glükóz oxidáz enzim működése
A ferrocén felfedezését, karakterizálását követően számos kutatócsoport irányította figyelmét ferrocénszármazékok, köztük a ferrocénkarboxamidok szintézisére. Az 1950-es évek második felére már több módszer is létezett az amidok előállítására.
Weliky és Gould jó néhány, különböző ferrocénszármazékokhoz vezető reakció utat dolgozott ki benzoil-ferrocénen keresztül. E vegyület oximjának Beckman-átendeződésével jutottak el a ferrocénkarboxanilidhez is (hozam 8%) [13].

Több N-szubsztituált ferrocénkarboxamidot állítottak elő Rausch és munkatársai ferrocénből kiindulva. A ferrocént csekély feleslegben lévő alumínium-kloriddal és a megfelelő izocianáttal reagáltatva közepes hozammal nyerték a kívánt karboxamidokat [14].

Az izocianát ![]() amid átalakítás
másik érdekes esete, amikor nem ferrocénnel reagáltatják a megfelelő
izocianátot, hanem lítium-ciklopentadieniddel. Ezután a
monokarbamoil-szubsztituált ciklopentadienid vas(II)-kloriddal lejátszódó reakciójából
kapják meg a monokarbamoil-, illetve dikarbamoil-ferrocént [15].
amid átalakítás
másik érdekes esete, amikor nem ferrocénnel reagáltatják a megfelelő
izocianátot, hanem lítium-ciklopentadieniddel. Ezután a
monokarbamoil-szubsztituált ciklopentadienid vas(II)-kloriddal lejátszódó reakciójából
kapják meg a monokarbamoil-, illetve dikarbamoil-ferrocént [15].

(1.8)
Gyakran alkalmazott módszer a ferrocénkarbonsav kloridjával történő acilezés. Némi hátrányt jelent azonban a savklorid nagy reakcióképessége ami megnehezíti a vegyület előállítását, tisztítását, tárolását (ferrocénkarbonsavból számított hozam: 20-40% ) [16].
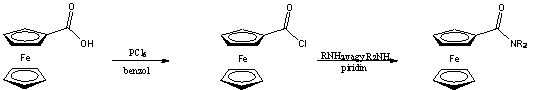
Ezt a hátrányt igyekezett kiküszöbölni Rotello azzal, hogy a szintézis intermediereként a megfelelő savfluoridot használta, amely megfelelően reaktív az amid képzéshez, ugyanakkor elég stabilis ahhoz, hogy tisztítása (átkristályosítás, szublimáció, kromatográfia) könnyen megoldható legyen, emellett szobahőmérsékleten bomlás nélkül eltartható [17].
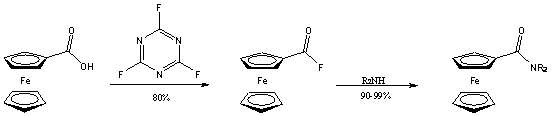
A savklorid és az amin kapcsolása általában bázis hozzáadását igényli, hogy az megvédje a támadó nukleofil reakciópartnert a protonálódástól. Meglepő, hogy savfluorid esetében erre nincs szükség, ami további előnyöket jelent használatakor. Először is, bázisra érzékeny szubsztrátum jelenlétében nem játszódik le mellékreakció, másodszor, nincs szükség vizes feldolgozásra a reakció végén.
Speiser azt vizsgálta, hogy különböző karbodiimidek hogyan képesek aktiválni a ferrocénkarbonsavat, hogy az erős nukleofil reagenssel támadható legyen. A legtöbb vizsgált N,N'-diszubsztituált karbodiimid a ferrocénkarbonsavval igen stabil N,N'-diszubsztituált N-ferrocén-karbamid származékot eredményezett, kivéve az 1-etil-3-(3-dimetil-amino-propil)-karbodiimid-hidrokloridot (EDC). Éppen ezért alkalmas ez utóbbi karbodiimid a ferrocén-karbonsav aktiválására. Ferrocénkarbonsav, EDC és 3-(trietoxi-szilil)-propil-amin reakciójában közepes hozammal szintetizálták a megfelelő ferrocénkarboxamidot
A leírt módszerek - 1,1'-ferrocén-dikarbonsavból kiindulva - természetesen alkalmasak 1,1'-ferrocéndikarboxamidok szintézisére is. Az 1,1'-heterodiszubsztituált ferrocéndikarboxamid származékok előállítása azonban némileg bonyolult, hosszadalmas, többlépéses szintézist igényel azáltal, hogy a legtöbb esetben az egyik karboxilcsoportot védeni, míg a másikat aktiválni kell. A védőcsoport eltávolítását újabb aktiválási lépés követi és ezek után alakulhat ki a nem szimmerikus ferrocéndikarboxamid származék. Ez lehet az egyik oka, hogy ilyen vegyületek szintézisére csak elvétve találunk példát az irodalomban. Az egyik példa Sekine és munkatársai nevéhez fűződik. Ferrocéndikarbonsav-metil-észtert reagáltattak N-(t-butoxi-karbonil)-1,3-propándiaminnal 2-klór-1-metil-piridinium-jodid (CMPI) és tributil-amin jelenlétében (1.lépés) (hozam:89%). Majd a karbonsav-észter lúgos hidrolízise (2.lépés) után az előzővel megegyező módon alakították át a másik karboxilcsoportot 3-amino-propánsavval (1.11 egyenlet) (3.lépés) (hozam: 62%) [19].
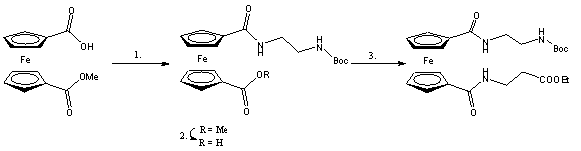
Említést érdemelnek még ebben a fejezetben Kraatz és munkatársai, akik főként N-ferrocenoil-aminosav-észterek, N-ferrocenoil-peptidek előállításában és vizsgálatában alkottak maradandót, de ugyanazon módszerrel karboxamidokat is szintetizáltak (lásd következő fejezet) [20].
A ferrocénkarbonsav amidszármazékai között különösen fontosak a N-ferrocenoil-aminosavak és -peptidek. Szolgálhatnak bioszenzorként (ld. 1.2.2. fejezet), de alkalmasak lehetnek a fehérjék bizonyos szerkezeti elemeinek modellezésére is.
Az első ferrocéntartalmú aminosav- és dipeptid származékokat (Fc-CO-Gly-OMe, Fc-CO-Gly-OH, és Fc-CO-Gly-Leu-OEt) Schlögl állította elő 1957-ben [21]. Ahhoz, hogy a peptidkötést enyhe körülmények között ki lehessen alakítani, a savat aktiválni kell. A ferrocenoil-aminosavak szintézise során a ferrocénkarbonsav aktiválására több megoldást is alkalmaztak (1.5 ábra):

1.5 ábra Ferrocénkarbonsav aktiválásának lehetőségei
Az aminosavak acilezésére alkalmas vegyület a karbonsav-klorid, melynek kialakítása oxaloil-kloriddal, vagy tionil-kloriddal történhet [21, 22].
További lehetőség a karbonsav átalakítása szukcinimiddé, vagy benzotriazol-észterré. Majd az aktivált ferrocénkarbonsav-származékot az aminosavészter oldatával 2 napig keverik (reakcióidő: 2 nap, a nyerstermék hozama: 70-80%) [23].
A karbonsav
aktiválása történhet HBTU-val, 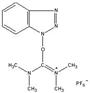 vagy TBTU-val
vagy TBTU-val is. Ez utóbbi megoldásnak több előnye is van: a kívánt kapcsolás rövid idő
alatt végbemegy, nem szükséges vízmentes oldószerek használata, megfelelő
extraktív feldolgozással a kapcsoló reagensek eltávolíthatóak, ezáltal kiváló
hozammal, nagy tisztaságú terméket nyerhetünk (reakcióidő: 30 perc, hozam:
52-87%) [24].
is. Ez utóbbi megoldásnak több előnye is van: a kívánt kapcsolás rövid idő
alatt végbemegy, nem szükséges vízmentes oldószerek használata, megfelelő
extraktív feldolgozással a kapcsoló reagensek eltávolíthatóak, ezáltal kiváló
hozammal, nagy tisztaságú terméket nyerhetünk (reakcióidő: 30 perc, hozam:
52-87%) [24].
Beck és munkatársai egy másik érdekes megoldást választottak az N-ferrocenoil-aminosav-észter előállítására. A karbonsavat EDC-vel aktiválták és ezzel egy időben hozzáadták az aminosav-észtert, emellett katalitikus mennyiségű 4-(dimetil-amino)-piridint (DMAP), valamint bázisként N-metil-morfolint használtak. A reakció hátránya a hosszú reakcióidő (1-3 nap) [25] (hozam 73-78%).
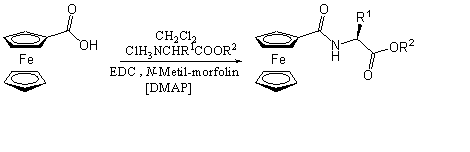
Az előző fejezetben tárgyalt lítium-ciklopentadienid és izocianát reakcióján alapuló módszert alkalmazva szintén állítottak elő ferrocenoil-aminosav-észtereket. Aminosav-észter-hidrokloridot feleslegben lévő difoszgénnel reagáltattak, hogy megkapják a kívánt izocianátot, majd a karboxamidok előállításánál leírt módon jutottak a mono-, illetve 1,1'-dikarbamoil-ferrocénhez [15].
Természetesen az itt tárgyalt módszerek mindegyike alkalmas 1,1'-diszubsztituált ferrocenoil-aminosav-észterek előállítására is, a megfelelő dikarbonsavból kiindulva.
Olyan 1,1'-heterodiszubsztituált ferrocenoil-aminosav származékok szintézisére, amikor két különböző aminosav, vagy peptid kapcsolódik a ferrocén két Cp gyűrűjéhez - a hasonló szerkezetű amidokhoz hasonlóan - jóval kevesebb példát találunk az irodalomban. Az általunk közzétett eredményeken kívül (melyeket a kísérleti részben ismertetek) mindössze három olyan publikáció született, amely a nem szimmetrikusan helyettesített 1,1'-ferrocén-dikarbonsav aminosav-, vagy peptid-származékait tárgyalja. Az egyiket Kimura és munkatársai tették közzé, akik sajnos a szintézis részleteit nem közölték [26]. A másik két közlemény Kraatz, illetve Metzler-Nolte nevéhez fűződik.
Kraatz az 1,1'-ferrocén-dikarbonsavat reagáltatta egyidejűleg Pro3-OBzl-rel és hidroxi-benzotriazollal (HOBt). Az így kapott termékelegyből oszlopkromatográfiával elkülönítette a Fe[C5H4-CO-Pro3-OBzl][C5H4-CO-OBt]-t (hozam: 45- 55%). Majd következő lépésként az OBt-csoportot cserélte a másik peptidre (Val-Val-Sta-Ala-Sta-OEt) (hozam: 55- 59%)[27].
Metzler-Nolte az 1,1'-ferrocén-dikarbonsavat HBTU és HOBt 1:1 arányú elegyével aktiválta, bázisként diizopropil-etil-amint használt. Ehhez adta a kétféle aminosavészter hidrokloridjának (Ala-OMe.HCl és Phe-OMe.HCl, illetve DPhe-OMe.HCl és Ala-OMe.HCl) a ferrocén-dikarbonsavra nézve fél ekvivalens, 1-1 arányú elegyét. Hat óra elteltével megismételte az aktivációs lépést, majd újabb adag aminosavészter hidroklorid elegy hozzáadását követően egy teljes éjszakán át keverte (hozam: 29% és 23%). [28]
Az elmúlt évtizedekben az átmenetifém-organikus kémia fejlődése a szerves szintézisutak forradalmi változását idézte elő. Az ismert átmenetifém-organikus vegyületek közül a palládiumkomplexek váltak a legfontosabb katalizátorokká akár az alapvető nyersanyagok, a finomvegyszerek, vagy bonyolultabb, a természetben is előforduló anyagok előállítását vesszük figyelembe. A palládiumkatalizátorok jelenlétében lejátszódó átalakulások sokfélesége, a reakciók kitűnő kemo-, regio- és sztereoszelektivitása lehetővé teszi olyan rendkívül összetett molekulák szintézisének megvalósítását, amely a klasszikus szerves kémia módszereivel nem, vagy csak nagyon nehezen oldható meg.
A palládiumkatalizátorok többek között lehetővé teszik, hogy egy molekula telítetlen szénatomján új szén-szén kötést hozzunk létre (Heck reakció-, vagy különböző fémorganikus reakciópartnerekkel lejátszódó kapcsolási reakciók segítségével), vagy C-heteroatom (C-N, C-P, C-S, stb) kötést alakítsunk ki a palládiumkomplex jelenlétében lejátszódó nukleofil szubsztitúció révén. További előnyük, hogy képesek különböző kis molekulák, köztük a szén-monoxid aktiválására, mely így közvetlenül beépíthető valamely szerves molekulába. Az utóbbi folyamat karbonilvegyületek- vagy karbonsavszármazékok képződéséhez vezet.
A fenti reakciók kiindulási vegyületei a legtöbb esetben aril- vagy alkenil-halogenidek, illetve aril- vagy enol-triflátok, melyek a katalitikusan aktív palládiumkomplexszel reakcióba lépve szén-palládium kötést tartalmazó aril- vagy alkenil-palládium komplexek képződéséhez vezetnek. A központi palládiumatomhoz kapcsolódó telítetlen szénatomok a palládium "közvetítésével" reakcióba léphetnek különböző nukleofil reakciópartnerekkel (alkénekkel, fémorganikus reagensekkel, aminokkal, stb.). A halogénszármazékok közül - bár ezek a legdrágábbak - kitűnő reakciókészségük miatt a jódvegyületeket alkalmazzák elsősorban. Számos példa található azonban a brómszármazékok átalakítására is, az utóbbi időben pedig egyre többen foglalkoznak a legkönnyebben hozzáférhető aril-kloridok reakcióival [29].
A bevezetésben említett reakciók esetében - legyenek azok egy elektrofil és nukleofil reakciópartner között végbemenő kapcsolási reakciók, vagy szén-monoxid jelenlétében lejátszódó karbonilezési reakciók - az aktív katalizátor valamilyen Pd(0)-komplex. Az aktív részecske a reakcióelegyben alakul ki, a fő kérdés általában az, milyen palládiumvegyületek hozzáadásával érhetjük el a legjobb eredményt. A leggyakrabban használt katalizátorrendszerek vagy már eleve 0-oxidációfokú palládium komplexet tartalmaznak, ilyen például a Pd(0)(PPh3)4 vagy a Pd(0)(dba)2 + nL rendszer, vagy olyan Pd(II)komplexek vagy Pd(II) sók, amelyekből a reakcióelegyben "in situ" alakul ki az aktív részecske valamilyen redukálószer (pl. egy amin, vagy a ligandumként használt foszfán) hatására. Az ilyen típusú katalizátorokra példa a PdX2L2 vagy Pd(OAc)2 + nL rendszer (L:egyfogú foszfán, X=Cl, Br, I).
A fejezet további részében a karbonilezési reakciókon kívül kizárólag azoknak a palládium-katalizált homogénkatalitikus reakcióknak a bemutatására szorítkozom, melyeket már alkalmaztak az általam is kiindulási anyagnak választott jód-, illetve 1,1'-dijód-ferrocén átalakítására. Jód-ferrocén és 1,1'-dijód ferrocén karbonilezését kutatócsoportunk valósította meg első ízben. A munkám jelentős részét képező karbonilezéssel kapcsolatos általános tudnivalókat az 1.5.2. fejezetben tárgyalom.
Bár a ferrocén reakcióiban az aromás vegyületekhez hasonló módon viselkedik, és az aril-halogenidek palládium-komplexek jelenlétében lejátszódó homogénkatalitikus reakcióit szívesen alkalmazzák aromás származékok szintézisére, a jód-ferrocén és dijód-ferrocén hasonló átalakítására viszonylag kevés példát találunk az irodalomban. A ferrocénszármazékok szintézisének legelterjedtebb kiindulási anyaga még mindig a ferrocénkarbonsav, illetve annak aktivált származékai.
Új szén-szén kötés kialakítása minden időben a szintetikus szerves kémia meghatározó átalakításai közé tartozott. A klasszikus C-C kötést létrehozó módszerek (pl. Grignard reakció, Wittig reakció, cikloaddíció stb.) mellett az elmúlt 30 évben az átmenetifémek (Pd, Ni, Cu) által katalizált keresztkapcsolási (cross-coupling) reakciók jelentősen kiterjesztették a szintetikus lehetőségeket.
A fémorganikus reagensek jelenlétében lejátszódó kapcsolási reakciók általában palládium(0) vagy nikkel(0) katalizálta reakciók. A kapcsolási reakció mechanizmusát leegyszerűsítve az 1.6 ábra mutatja be. A folyamat nyitó lépése egy szerves (általában halogén-) vegyület oxidatív addíciója az alacsony oxidációs állapotú átmenetifémre. A kapcsolni kívánt másik szerves molekularészlet a keletkező intermedierről ligandumcserével kerül az átmenetifémre. Általában ez a reakció a folyamat sebesség-meghatározó lépése. A transz elhelyezkedésű csoportok egy gyors izomerizációs lépés eredményeként cisz-helyzetbe kerülnek, majd a záró reduktív eliminációs lépés eredményeképpen kialakul a kapcsolt termék és a katalitikus ciklus bezárul az alacsony oxidációs állapotú átmenetifém újraképződésével.
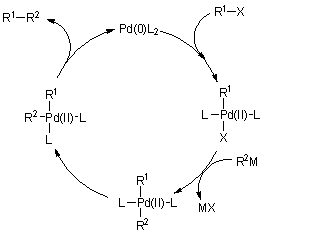
1.6 ábra A fémorganikus reakciópartnerek jelenlétében lejátszódó kapcsolás általános mechanizmusa
A leggyakrabban használt katalizátorok vagy már eleve 0-oxidációfokú palládiumot tartalmazó vegyületek, vagy olyan Pd(II)komplexek vagy Pd(II) sók, amelyekből a reakcióelegyben "in situ" alakul ki az aktív részecske valamilyen redukálószer (foszfán, fémorganikus reagens, trietil-amin) hatására.
Az elektrofil reakciópartner, amelynek oxidatív addíciójával a folyamat elindul, elsősorban aril/alkenil-halogenid, vagy -triflát. A fémorganikus reakciópartnerek között találunk ón- (Stille kapcsolás) [30], bór- (Suzuki kapcsolás) [31-35], cink-, alumínium- és cirkónium- (Negishi kapcsolás) [36, 37], szilícium- és germánium- [38, 39] lítium- és magnézium- [40], valamint indiumvegyületeket [41].
A keresztkapcsolási eljárások legelterjedtebb és részleteiben is ismert képviselője a Stille nevével fémjelzett reakció. A folyamatban a ligandumcsere az ónorganikus vegyület és a palládiumkomplex között játszódik le.
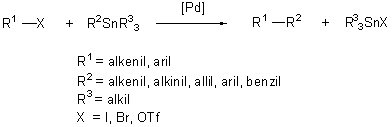
(1.13)
A kapcsolási reakcióban az ónatomon lévő csoportok közül csak az egyik vesz részt. Szerencsére az ónról a legkülönbözőbb csoportok vihetők át szelektíven, hiszen az alkil-transzfer sebessége jóval kisebb, mint a telítetlen csoportoké. Így az általánosan alkalmazott ónreagensek nem szimmetrikusak, három alkilcsoportot (metil-, vagy butil-) negyedikként pedig alkinil-, alkenil-, aril-, benzil- vagy allilcsoportot tartalmaznak. A módszernek számos előnye van: a kereskedelmi forgalomban sokféle trialkil-ón származék megtalálható. E vegyületek általában kevéssé érzékenyek oxigénnel, vagy nedvességgel szemben. A reakció szelektivitása kitűnő, emellett enyhe reakciókörülmények között, számos funkciós csoport (OH, NH, COOH, CHO) jelenlétében végbemegy anélkül, hogy szükség lenne védőcsoportok alkalmazására [30]. Mindezek a tulajdonságok elsősorban az ón-szén kötés kis polaritásának köszönhetők. A kapcsolást különösen eredményesen használják több funkciós-csoportot tartalmazó, bonyolult szerkezetű molekulák átalakítására. A Stille-kapcsolás hátránya viszont az ónvegyületek közismert toxikus hatása és a reakcióban keletkező trialkilón-halogenidek eltávolításának problémája
Ferrocénvázas vegyületek előállításánál is találunk néhány olyan példát, ahol Stille-kapcsolást alkalmaztak, azonban ezekben az esetekben a ferrocénszármazék az ónorganikus reakciópartner (ferrocenil-tributil-sztannán) nem pedig a halogenid. A Stille-reakció tárgyalását ebben a fejezetben az teszi mégis indokolttá, hogy munkám során általam előállított jód-ferrocén-származékok átalakítására alkalmaztam ezt a kapcsolási reakciót. (Lásd kísérleti rész 2.3.1 fejezet 2.6 egyenlet)
A Suzuki-reakció talán a keresztkapcsolási reakciók legsokoldalúbb fajtája. A felhasznált bórorganikus vegyületek szintén csökkent nukleofil karakterrel rendelkeznek (ezért számos funkcióscsoport jelenlétében kivitelezhető a kapcsolás védőcsoportok kialakítása nélkül is), valamint oxigénnel és nedvességgel szemben stabilak. A módszer további értékes tulajdonsága, hogy a kiindulási boronsavak és származékaik nem toxikusak, a reakció vizes közegben is elvégezhető és a képződő bórsav nem zavarja a tisztítási eljárásokat. Fontos megemlíteni, hogy a ligandumcsere során - más keresztkapcsolási reakcióktól eltérően - egy ekvivalens bázis jelenlétére van szükség. Mivel a szerves bórszármazék nukleofil ereje nem elég nagy, így az organopalládium-halogenidet kell elektrofilebbé tenni, a halogenidet alkoxi- vagy karbonátionra cserélve. Feltételezések szerint a reakcióközegben jelenlevő alkoxid/karbonát/hidroxidionok nem csak a palládium elektrofil jellegét fokozzák, de a bórorganikus vegyület nukleofil jellegét is oly módon, hogy egyensúlyi addícióban anionos boronátkomplexet képeznek vele.
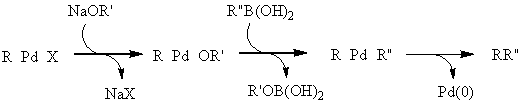
![]()
Aril-ferrocének előállítására a Suzuki-kapcsoláson belül is több lehetőségünk van. Először is a ferrocenilcsoportot képviselheti egyrészt az aril-boronsav, másrészt a haloferrocén is. Mivel a ferrocén-boronsav és a jód-ferrocén (vagy bróm-ferrocén) elérhetőségét, stabilitását tekintve nem nagyon különböznek egymástól, a választást inkább a másik reakciópartner kezelhetősége határozza meg. Döntő jelentőségű a katalizátorrendszer, a bázis, illetve az oldószer megfelelő megválasztása. Knapp és Rehahn összehasonlította a ferrocén-diboronsav / fenil-halogenid és dihaloferrocén / fenil-boronsav reakciópartner párok reakcióit két különböző rendszerben (A: toluol / 2M Na2CO3-oldat / Pd(PPh3)4; B: DME / 3M NaOH-oldat / PdCl2(dppf)). Az A módszer alkalmazásakor a dijód-ferrocén : fenil-boronsav pár esetén volt jóval nagyobb a konverzió (55% / 25%), míg a B esetén mindkét reakciópartner pár alkalmazása azonosan jó eredményt mutatott (konverzió: 90%) [42].
Imrie jód-ferrocént reagáltatott különféle szubsztituált fenil-boronsav származékokkal Suzuki-reakcióban. A paraméterek fokozatos változtatásával meghatározta az optimális reakciókörülményeket: 90%-os etanol mint oldószer, palládium-acetát katalizátor, és nátrium-karbonát, vagy bárium-hidroxid bázis bizonyult legelőnyösebbnek. [43]
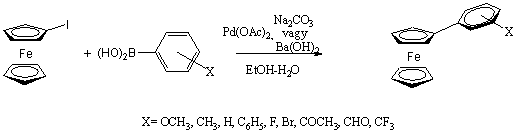
(1.15)
A benzol gyűrűhöz kapcsolódó elektronküldő szubsztituensek növelik a reakció sebességét azáltal, hogy ezek a csoportok nukleofilabbá teszik a fenil-boronsav származékot. Elektronszívó szubsztituens esetén az ellenkezője tapasztalható.
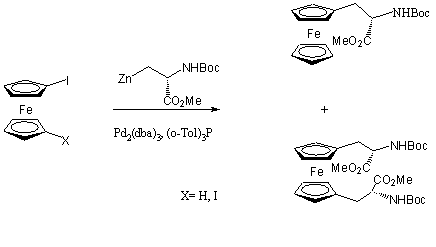
A keresztkapcsolási reakciók következő változata, amelyet jód-, illetve dijód-ferrocén átalakítására is használtak, a cinkorganikus reagensek jelenlétében lejátszódó Negishi-reakció. A cinkorganikus vegyületek alkalmazása mellett szól, hogy viszonylag könnyen hozzáférhetőek, a funkciós csoportok egy jelentős részénél nincs szükség védőcsoportok alkalmazására, és a cink és palládium közti ligandumcsere már szobahőmérsékleten is gyorsan lejátszódik. Hátrányuk, hogy nedvességre és oxigénre érzékenyek.
Jód-, illetve 1,1'dijód-ferrocén és egy cinkorganikus szerin származék palládium katalizált kapcsolási reakciójában az 1.16 egyenletben látható termékek keletkeztek. 1,1'-dijód-ferrocén kiindulási anyag esetén a cinkorganikus reagens feleslegének növelése a diszubsztituált ferrocén származék keletkezését jelentős mértékben elősegítette [44].
(1.16)
Aril-alkinek és konjugált eninek legkényelmesebb előállítási módja az aril- vagy alkenil-halogenidek palládium katalizált kapcsolása terminális alkinekkel. Sonogashira nevéhez fűződik az a felismerés, hogy in situ előállított alkinil-réz reagensek az előbb említett kapcsolási reakcióba vihetők.
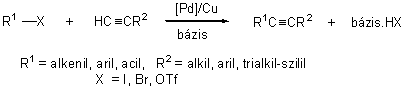 (1.17)
(1.17)
Ez a folyamat végső soron két katalitikus reakció: a palládiumkomplexek réz-katalizált alkinilezése (1.7 ábra "B" ciklus), valamint az sp2-szénatomokat tartalmazó halogenidek és terminális acetilének palládium jelenlétében lejátszódó kapcsolása kombinációjaként fogható fel (1.7 ábra "A" ciklus) [45]. Bár a reakció valószínűleg az 1.5.1.1. fejezetben bemutatott fő lépéseket (oxidatív addíció, fémek közti ligandumcsere, reduktív elimináció) követve játszódik le, pontos mechanizmusa nem ismert. A katalitikusan aktív részecskék szerkezetével és a CuI kokatalizátor valódi szerepével kapcsolatban nem állnak rendelkezésünkre biztos adatok. Az oxidatív addíciót követően a palládium(II)komplex reakcióba lép a terminális acetilénnel, valószínűleg egy átmenetileg képződő réz-acetilid intermedier közreműködésével, majd a keletkező alkinil-palládium(II) vegyületből reduktív eliminációval képződik a termék. Katalizátorként leggyakrabban a PdCl2(PPh3)2 komplexet használják. Feltételezik, hogy a katalitikusan aktív részecske ekkor a Pd(II)komplex és az acetilén reakciójában képződő Pd-acetilid komplexből jön létre reduktív elimináció útján (1.7 ábra "C" ciklus). Az előbb említett palládiumvegyületen kívül általánosan alkalmazzák még a Pd(0)(PPh3)4, illetve Pd(0)2(dba)3 + foszfán típusú katalizátorokat is. A kis reakciókészségű aril-bromidok átalakításánál gyakran a 2/1-nél nagyobb foszfán/palládium aránnyal dolgoznak, hogy a szükséges magasabb hőmérsékleten elkerüljék a katalizátor bomlását, fémpalládium kiválását.

1.7 ábra A Sonogashira kapcsolás mechanizmusa
Mivel a kokatalizátorként használt réz-sók oxidatív körülmények között elősegítik az alkinek úgynevezett Glaser-típusú homokapcsolását, mely a megfelelő szimmetrikus diint eredményezi melléktermékként, az utóbbi néhány évben számos kutatócsoport koncentrált a réz-mentes Sonogashira kapcsolás megvalósítására [46-49].
Ferrocénvázas vegyületek esetében a jód-ferrocén, illetve a dijód-ferrocén és a legkülönbözőbb terminális alkinek (fenil-acetilén, acetilén [50], 1,4-dietinil-benzol [51, 52], 4-etinil-piridin, 5-etinil-bipiridin [53]) kapcsolása, változatos ferrocénvázas acetilén származékok képződését eredményezte 45-96%-os hozamok mellett.
A s-kötésű átmenetifém-organikus vegyületekből kiinduló szén-szén kötés kialakulásához vezető folyamatok közül a keresztkapcsolási reakciók mellett szintén nagy jelentőségű az alkén karbopalladálásából, majd az azt követő b-eliminációból álló folyamat, amelyet felfedezőjéről Heck-reakciónak neveztek el. A 1.8 ábrán látható katalitikus ciklus első lépése ebben az esetben is az aril-halogenid és a palládium között lejátszódó oxidatív addíció. A kialakult σ-kötésű palládiumorganikus vegyülethez koordinálódik az alkén, majd a beékelődést követően olyan alkilpalládium-komplexhez jutunk, melyből egy rotáció után kialakul az eliminációhoz szükséges szin-periplanáris Pd-C-C-H elrendeződés. Így lehetőség nyílik a β-elimináción keresztül megvalósuló stabilizációra, mely az alkén termék képződéséhez vezet. A hidrogén-halogenid eliminációja, mely a hozzáadott bázis hatására megy végbe, a katalitikus ciklus záródását, az aktív katalizátor regenerálását eredményezi.
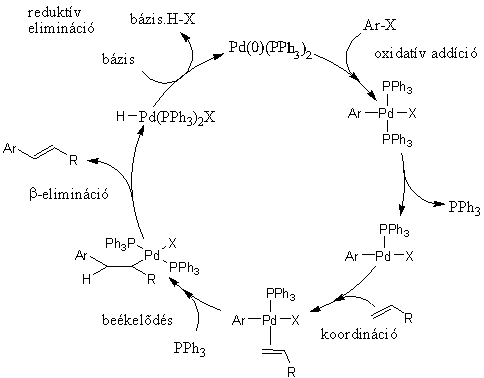
1.8. ábra A Heck-reakció mechanizmusa
Olyan Heck-reakciókban, amikor a β-elimináció során nem az eredeti C=C kötést regeneráljuk, a reakcióban általában új kiralitáscentrum alakul ki. Ilyen esetekben királis ligandumok alkalmazásával elvileg lehetőségünk van enantioszelektív átalakításokra.
A Heck reakció során elérhető konverzió és szelektivitás természetesen jelentős mértékben függ a reakciópartnerektől, de emellett befolyásolható a körülmények - oldószer, katalizátor, bázis, esetleg valamilyen egyéb adalék - megfelelő megválasztásával. Az eredetileg Heck által közölt Pd(OAc)2/PPh3/Et3N katalizátor-bázis párosításon kívül általánosan alkalmazzák a Jeffery [54] által kidolgozott Pd(OAc)2/K2CO3/nBu4NCl rendszert DMF vagy DMSO oldószerben. Ez utóbbi esetben a kvaterner ammóniumsó szerepe a feltételezések szerint az, hogy a kialakuló palládiumkolloidot stabilizálja, megakadályozza az aggregációt [55]. E két, már-már klasszikussá váló módszer mellett számos katalizátor-bázis-oldószer összeállítást kipróbáltak már.
Kasahara és munkatársai írták le először olefinek palládium katalizált reakcióit jód-, illetve 1,1'-dijód-ferrocénnel. A szokásos Heck körülmények között reagáltatták a halogeno-ferrocéneket az alkének legkülönbözőbb képviselőivel: egyszerű olefinekkel (sztirol), akrilsav származékokkal (etil-akrilát, metil-metakrilát, akrilnitril), telítetlen ketonokkal (metil-vinil-keton, fenil-vinil-keton), allil-alkoholokkal (allil-alkohol, 3-butén-2-ol) és telítetlen acetátokkal (vinil-acetát, izopropenil-acetát, acetofenon-enol-acetát).
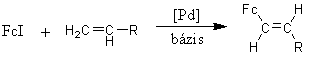
(1.18)
Allil-alkoholok és jód-ferrocén reakciója minden esetben ferrocén-karboxaldehidet vagy -ketont eredményezett.
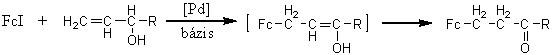
(1.19)
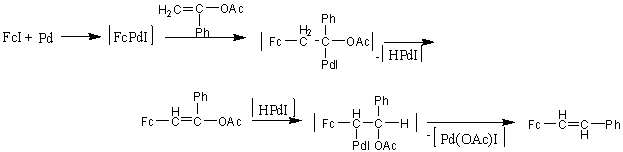
Vinil- és izopropil-acetát jód-ferrocénnel való Heck-kapcsolása diferrocenil-etilén, illetve 1,2-diferrocenil-1-propén termékhez vezetett, míg acetofenon-enol-acetát esetében sztiril-ferrocénből és 1-acetoxi-1-fenil-2-ferrocenil-etilénből álló termékelegyet kaptak. A sztiril-ferrocén képződése a következőképpen játszódhat le: a ferrocenilcsoportot b-pozícióban tartalmazó terméket eredményező b-eliminációt követően a hidrido-palládium komplex újra addícionálódik oly módon, hogy most palládium a ferrocénnel szomszédos szénatomra kerül. Egy Pd(OAc)I komplex eliminációt követően megkapjuk a sztiril-ferrocént [50].
(1.20)
Frejd és Calström 1,1'-dijód-ferrocént reagáltatott Heck reakcióban etil-2-[(terc-butoxi-karbonil)-amino]-akriláttal Jeffery körülmények között (1.21 egyenlet) [56].
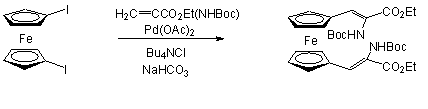
A regioszelektivitást befolyásolja az olefin molekula kettős kötésén lévő szubsztituens donor/akceptor tulajdonsága: elektron-donor szubsztituens (pl. alkoxicsoport) jelenléte az a-helyzetben helyettesített termék mennyiségét növeli [57]. Herrmann és munkatársai ferrocenil-etenil-szilatrán szintézisét valósította meg jód-ferrocén és 1-etenil-szilatrán Heck-kapcsolásával. Mivel a szilatráncsoport erős elektron-donornak mondható, a fent említettek alapján a kapcsolás eredményeként a- és b-pozícióban helyettesített termékek elegye várható. Meglepetésre azonban kizárólag a-termék keletkezett, függetlenül attól, hogy milyen körülmények között (katalizátor, oldószer, bázis, stb.) történt a reakció. Ezek változtatása ugyanis csak a konverziót befolyásolta, a regioszelektivitásra nem volt hatással [58].
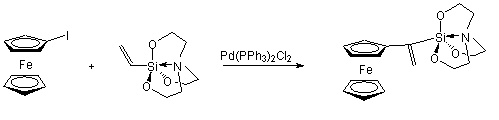 (1.22)
(1.22)
Az a-termék kizárólagos keletkezése a szilatráncsoport elektrondonor sajátságán túlmenően valószínűleg annak köszönhető, hogy a nagy térkitöltésű csoport miatt sztérikus gátlás lép fel. Az 1.8 ábrán bemutatott beékelődési lépésben a szintén nagy térigényű palládium-komplex inkább a b-helyzetű szénatomra kerül.
Mivel a palládiumkomplexek alkalmasak a szén-monoxid aktiválására, palládiumkatalizátorok segítségével ezt a molekulát közvetlenül beépíthetjük szerves vegyületekbe. A fémorganikus reakciópartnerekkel, vagy alkinekkel végbemenő kapcsolási reakciók módosításával, inert körülmények helyett szén-monoxid atmoszféra alkalmazásával különböző karbonilvegyületek szintézisére nyílik lehetőség. Egyéb nukleofil reakciópartnerek (víz, alkoholok, aminok) jelenlétében karbonsavszármazékokhoz juthatunk.
A szén-monoxid atmoszférában lejátszódó reakciók mechanizmusa nagyon hasonló az eddig ismertetett, palládiumkomplexek jelenlétében lejátszódó folyamatokéhoz. Az egyetlen lényeges különbség, hogy a katalitikusan aktív Pd(0)komplex és az aril/alkenilhalogenid, vagy -triflát reakciójában képződő aril/alkenil-palládium(II) vegyületből a szén-monoxid beékelődése révén acil-palládium(II) komplex alakul ki. Ez a továbbiakban reakcióba léphet egy fémorganikus reagenssel (1.10 ábra, "A" reakcióút), acetilén-származékokkal ("B" reakcióút),

1.9 ábra A szén-monoxid atmoszférában lejátszódó palládium-katalizált reakciók mechanizmusa
vagy nukleofil vegyületekkel ("C" reakcióút). Az első reakciótípusnál az 1.5.1.1. fejezetben leírtakhoz hasonlóan a fémek közti ligandumcsere vezet a termék kialakulásához és a katalitikusan aktív részecske regeneráláshoz. "A", "B" és "C" reakcióút esetén a termék képződését HPd(II)L2X típusú komplex kialakulása kíséri, melyből bázis jelenlétében HX reduktív eliminációja révén nyerjük vissza a Pd(0)komplexet.
A karbonilezés során alkalmazott katalizátorok, bázisok és oldószerek alapvetően megegyeznek az inert atmoszférában lejátszódó kapcsolási reakcióknál ismertetettekkel.
Szerves-halogenidek palládium-katalalizált karbonilezése nukleofil reakciópartner jelenlétében - mely karbonsavakat, észtereket, karbonsav-amidokat, vagy egyéb karbonsav származékokat eredményez - széles körben alkalmazott folyamat mind a laboratóriumi szintézisekben, mind pedig az ipari eljárásokban.
Az aminokarbonilezési reakció mechanizmusa több módon képzelhető el (1.10. ábra). A palládium-katalizált homogénkatalitikus reakciók régóta tanulmányozott mechanizmusa alapján elfogadott tény az organopalládium-halogenid kialakulása a szerves-halogenid katalitikusan aktív Pd(0) komplexre történő oxidatív addíciója révén. A katalitikus reakció további lefolyása azonban erősen függhet a reakció körülményeitől.

1.10. ábra A palládium-katalizált aminokarbonilezés reakciómechanizmusa
Az egyik alternatíva (1.10. ábra, "a" reakcióút), hogy az aril-halogenid oxidatív addícióját követően kialakult komplexhez (A) egy szén-monoxid molekula koordinálódik és kialakul egy aril-karbonil-palládium-komplex (B). Ebből bázis jelenlétében az amin támadása révén kialakul egy aril-karbamoil-palládium komplex (C). Végül egy reduktív eliminációs lépés segítségével jutunk az ArCONR2 termékhez [59, 60].
A másik lehetőség, amikor egy szén-monoxid molekula beékelődésével egy acil-palládium komplex (D) keletkezik. Ez reakcióba lép a nukleofil reagenssel (HNR2), melynek hatására felszabadul az ArCONR2 termék és egy bázis hozzáadásával visszakapjuk a katalitikusan aktív Pd(0) komplexet (1.10 ábra "b" reakcióút) [61].
Egyes feltételezések szerint nem zárható ki az sem, hogy az acil-palládium komplexből (D) eliminációval savhalogenid képződik, amely egyszerű SN reakcióban acilezi az amint (1.10. ábra "c" reakcióút) [62].
Valószínű, hogy a kiindulási vegyületek tulajdonságaitól függően egyik, vagy másik, vagy akár - különböző sebességgel - mindhárom reakciósor lejátszódik [59]. Hogy melyik mechanizmus milyen mértékben valósul meg, az függhet a reakciókörülményektől (pl. az oldószertől, az amin bázicitásától és sztérikus sajátságától, az aril-, vagy alkenil-halogenid tulajdoságától, az alkalmazott ligandum természetétől, stb.).
Aril-halogenidek homogénkatalitikus karbonilezési reakciói során végbemehet kettős karbonilezés is. Ekkor a nukleofil reakciópartnertől függően különféle a-keto-karbonsavszármazékok keletkeznek. Az aril-halogenidek ilyen típusú átalakítását a-keto-amidokká 1982-ben egymástól függetlenül fedezte fel Yamamoto és Ozawa [63], illetve Tanaka és Kobayashi [64].
Ezt követően részletes kutatásokat végeztek a kettős karbonilezés mechanizmusának felderítésére. A reakció alapvető lépéseit az 1.11 ábra mutatja be: az 1. lépés az oxidatív addíció, a 2. lépés a CO beékelődés. A 3. lépést, mely a szekunder amin reakciója az acil-palládium komplexszel (D) szén-monoxid jelenlétében, kétféleképpen képzelték el [65].
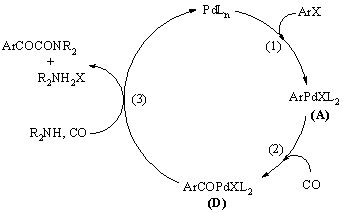
1.11 ábra Aril-halogenidek katalitikus kettős karbonilezésének elemi lépései szekunder amin jelenlétében.
Az első feltételezések szerint az első CO beékelődést egy újabb CO inzerció követheti. Ez egy glioxil-palládium komplexet (E) eredményez, melyből az amin támadás révén jutunk az a-keto-amid termékhez (1.23 egyenlet). Részletes vizsgálatok azonban cáfolták ezt az elképzelést.
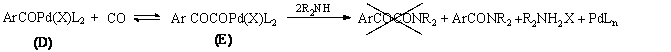
Yamamoto és munkatársai előzetesen kipreparált glioxil-palládium komplexet (E) reagáltattak szekunder aminnal, melynek eredményeként nem a várt ketoamid, hanem az amid keletkezett [66].
A másik eshetőség szerint az első CO beékelődését egy másik koordinációja követi, ezzel egy acil-karbonil-palládium komplexhez (F) jutunk, melyből az amin támadása révén egy acil-karbamoil-palládium komplexet (G) kapunk. Végül az a-keto-amid reduktív eliminációval képződik a (G) komplexből (1.24 egyenlet).

A kettős karbonilezést számos tényező befolyásolja. Ilyen lehet a nukleofil reagensként használt amin természete (sztérikus és elektronikus sajátságai), a felhasznált ligandum, a szubsztrátum tulajdonságai, a szén-monoxid nyomása, a reakció hőmérséklete, a hozzáadott bázis és az oldószer minősége.
A legjobb szubsztrátumnak az aril-jodidok bizonyultak. A para helyzetben elektronszívó csoporttal (CN, CF3) helyettesített aril-halogenid reakciókészsége megnő a nem szubsztituált származékhoz képest, ugyanakkor az a-ketoamid képződés szelektivitása lecsökken. Elektronküldő csoport jelenléte esetén az ellenkezője tapasztalható.
A CO nyomás növelése kedvez az a-ketoamid kialakulásának, azonban a túl nagy nyomás jelentősen csökkentheti a reakció sebességét.
A bázikusabb szekunder aminok hatékonyan alkalmazhatóak a kettős karbonilezési reakciókban, de az aminok geometriája jelentősen befolyásolja mind a szelektivitást, mind pedig a konverziót. Például az elágazó alkilcsoportokkal rendelkező di-izo-butil-amin teljesen inaktívnak bizonyult és a di-izo-propil-amin jelenlétében is csak amid képződést és csekély átalakulást figyeltek meg. A kisebb térkitöltésű csoportokkal rendelkező szekunder aminok azonban eredményesen alkalmazhatóak karbonilezési reakcióban, eltérő szelektivitással [59].
Watanabe és
munkatársai a hozzáadott bázis, illetve az oldószer hatásait vizsgálták di(m-kloro)bisz-(h -allil)dipalládium(II)
és trifenil-foszfán katalizátor rendszer alkalmazásával ( P/Pd = 2/1 ), 25°C-on,
légköri CO nyomáson. A különböző bázisok markáns különbségeket okoztak a ketoamid
hozamát tekintve. A Watanabe által vizsgált bázisok közül
(1,4-diazabiciklo[2.2.2]oktán (DABCO), trietil-amin, piridin,
1,8-diazabiciklo[5.4.0]undec-7-én (DBU)), a DABCO bizonyult messze a
leghatékonyabbnak tetrahidrofurán oldószerben [67]. Érdekes, hogy a DBU ilyen
körülmények között a-ketoamid keletkezésére
nézve teljesen hatástalan volt, míg az Inoue által kipróbált rendszerben (
Láthatjuk, hogy a különböző kutatócsoportok vizsgálatai alapján más-más reakciókörülmények adódnak optimálisnak, a reakció mechanizmusát tekintve azonban nagyjából egyetértés van (1.12 ábra). A különböző bázisok okozta eltérések magyarázata még nem teljesen tisztázott.

1.12 ábra A kettős karbonilezési reakció mechanizmusa.
A Pannon Egyetem Szerves Kémia tanszékén évtizedes múltra tekint vissza alkenil- és aril-halogenidek és -triflátok homogénkatalitikus karbonilezési reakcióinak vizsgálata [69-71]. Ezen kutatások keretein belül irányult a figyelem a jód-ferrocén kiindulási anyagként való felhasználására aminokarbonilezési reakcióban. Jód-ferrocént reagáltattak különböző szekunder aminokkal Pd-katalizátor jelenlétében szén-monoxid nyomás alatt. A kísérletek eredményeként új típusú ferrocénvázas a-ketoamidokat szintetizáltak, melléktermékként ferrocénkarbonsavamidok képződtek [72].
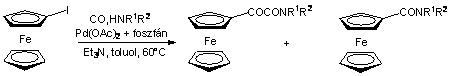
(1.25)
Megállapították, hogy a reakció szelektivitása jelentős mértékben függ a hőmérséklettől. Alacsonyabb hőmérsékleten a legtöbb esetben az a-ketoamidok voltak a fő termékek, míg a hőmérséklet növelése a monokarbonilezésnek kedvezett. A nyomás növelése egy ideig a konverzió és az a-ketoamidok hozamának növekedéséhez vezetett, ugyanakkor a nyomás 40 bar fölötti növelése az átalakulás csekély mértékű visszaesését eredményezte, míg az amid/ketoamid arány nem változott. A jelenséget azzal magyarázták, hogy a magas CO nyomás hatására megnövekszik a CO ligandumok száma a Pd koordinációs övezetében, ami nehezíti a jód-ferrocén oxidatív addícióját, ezáltal csökken a reakció sebessége.
A karbonilezés szelektivitását nagy mértékben befolyásolta a nukleofil reagensként alkalmazott amin térigénye. Míg a kisebb térkitöltésű szekunder aminok esetén (morfolin, Et2NH, nBuNH, piperidin, 3,5-dimetil-piperidin) az a-ketoamidot sikerült 60 oC-on jó hozammal előállítani, addig a terjedelmesebb, szerteágazóbb alkilcsoporttal rendelkező szekunder aminoknál (cHex2NH, 2-etil-piperidin, 2,6-dimetil-piperidin) - feltehetően az amin sztérikus gátlásának köszönhetően - a ketoamid keletkezése tekintélyes mértékben háttérbe szorult.
Az előbb leírt megfigyeléseket követően kapcsolódtam be a kutatásba. Elsőként azt vizsgáltam, hogy a jód-ferrocén aminokarbonilezési reakciójában alkalmazhatók-e aminosav-észterek mint nukleofil reagensek. Majd az 1,1'-dijód-ferrocén hasonló típusú átalakítását tanulmányoztam mind aminok, mind aminosav-észterek jelenlétében, különös tekintettel az 1,1'-heterodiszubsztituált származékok előállítására.
Kísérleteim során először a jód-ferrocén (1) és glicin-metil-észter reakcióját vizsgáltam (2.1. egyenlet).

(2.1.)
A reakciókörülmények kiválasztásánál a korábbi karbonilezési eredményeket vettem alapul (ld. 1.5.2.2. fejezet): az optimálisnak talált 40 bar CO nyomáson dolgoztam, katalizátor prekurzorként a korábbi jód-ferrocén karbonilezési kísérletekhez hasonlóan Pd(OAc)2 és 2 ekvivalens PPh3 elegyét használtam.
A katalitikus hatást ekkor egy Pd0 komplex fejti ki, amely in situ keletkezik a Pd(OAc)2 -ból a foszfin jelenlétében [73]. A PPh3 ezenkívül ligandumként is szolgál.
 (2.2.)
(2.2.)
Az alkalmazott katalizátor óriási előnye az egyéb palládium-tartalmú katalizátorrendszerekkel szemben, hogy sem a Pd-só, sem a ligandum nem igényel különleges tárolási feltételeket, nem érzékeny oxigénre és a levegő nedvességtartalmára, továbbá viszonylag olcsó.
Az előkísérletek során megállapítottam, hogy a szabad aminosav mint nukleofil nem alkalmazható a karbonilezés során. Ezért a továbbiakban a könnyen előállítható metil-észterek reakcióit vizsgáltam. A reakciók előrehaladását vékonyréteg-kromatográfiával, illetve gázkromatográfiás módszerrel követtem.
A glicin-metil-észter (Gly-OMe) mint nukleofil reakciópartner esetében kapott eredményeket az 1. táblázat mutatja be. A korábbi karbonilezési kísérletek alapján a jód-ferrocén (1) karbonilezése amid (2a), illetve a-ketoamid (3a) típusú termékekhez vezethet.
Toluol oldószerben trietil-amin bázis jelenlétében bár teljes átalakulást tapasztaltam, a gázkromatográfiás elemzés szerint a 2a amidszármazék csak 96 %-os hozammal keletkezett. A 3a ketoamid képződését nem tudtam kimutatni. Mivel azt tapasztaltam, hogy az aminosav-észter hidroklorid rosszul oldódik toluolban, ezért a továbbiakban THF-ben dolgoztam. Ekkor 100 oC-on teljes átalakulással, jó szelektivitással játszódott le a karbonilezés.
1. táblázat Jód-ferrocén (1) karbonilezése glicin-metil-észter jelenlétébena
|
Sorsz. |
Bázis |
Bázis/1 (mol/mol) |
Oldószer |
Hőm. (oC) |
R.idő (h) |
Konv.b (%) |
Hozamb (%) |
|
|
2a |
3a |
|||||||
|
1 |
Et3N |
6 |
toluol |
100 |
8 |
100 |
96 |
0 |
|
2 |
Et3N |
6 |
THF |
100 |
8 |
100 |
100 |
0 |
|
3 |
Et3N |
6 |
toluol |
60 |
8 |
71 |
58 |
5 |
|
4 |
Et3N |
6 |
THF |
60 |
8 |
82 |
73 |
9 |
|
5 |
DBU |
6 |
THF |
100 |
8 |
100 |
58 |
4 |
|
6 |
DBU |
8 |
THF |
100 |
8 |
96 |
9 |
32 |
|
7 |
DBU |
8 |
THF |
60 |
12 |
100 |
8 |
13 |
|
8 |
DBU |
10 |
THF |
100 |
2 |
100 |
4 |
12 |
aReakciókörülmény: jód-ferrocén (1) (0,5 mmol), glicin-metil-észter hidroklorid (2,5 mmol), Pd(OAc)2 (0,025 mmol), PPh3 (0,05 mmol), 12,5 ml oldószer, 40 bar CO. bGC alapján (belső standard: eikozán).
Mivel a korábbi eredmények alapján a hőmérséklet csökkentése az a-ketoamidok képződésének kedvez [72], további kísérleteket végeztem a 3a vegyület előállítása érdekében.
Trietil-amin bázis jelenlétében lejátszódó reakcióban 60°C-on ugyan mind toluol, mind THF oldószerben sikerült 3a képződését kimutatnom, de a fő termék továbbra is az amid (2a) maradt.
Mivel úgy tűnt, hogy a hőmérséklet csökkentésével döntően nem befolyásolható a reakció szelektivitása, a további kísérletekhez az irodalom alapján egy másik bázist, a DBU-t választottam. Inoue és munkatársai jód-benzol dietil-amin jelenlétében lejátszódó karbonilezésénél ugyanis megfigyelték, hogy míg piridin, vagy dietil-amin bázis hozzáadásával közepes szelektivitást értek el, addig DBU jelenlétében jó hozammal keletkezett a megfelelő a-ketoamid. [68]
Mivel a nukleofil reakciópartner, a glicin-metil-észter hidroklorid a szubsztrátumhoz képest ötszörös feleslegben volt jelen, a jód-ferrocénre nézve 6, majd 8, végül 10 ekvivalens mennyiségű DBU-val dolgoztam.
Míg 6 ekvivalens DBU esetén az a-ketoamid/amid arány a korábbi, 60 oC-on végzett kísérletekhez képest nem növekedett, a DBU mennyiségét 8 ekvivalensre emelve e tekintetben jelentős javulást figyeltem meg. A termékek hozama azonban a gázkromatográfiás eredmények alapján nagyon alacsony volt.
A termékelegy részletesebb vizsgálata azt mutatta, hogy ez többféle okra vezethető vissza. Egyrészt a vékonyréteg-kromatográfiás vizsgálatok szerint a termékek DBU jelenlétében nem inert körülmények között már szobahőmérsékleten is bomlást szenvedtek. Megfigyeltem viszont, hogy 2a és 3a THF-es oldata órákon át stabil maradt, így a továbbiakban a feldolgozás első lépését, a DBU eltávolítását inert körülmények között végeztem, így a bomlást sikerült elkerülnöm (ld. 2. táblázat).
DBU jelenlétében a két termék a gázkromatográfiás vizsgálat körülményei között is bomlott, a bázis mennyiségének növelésével párhuzamosan csökkenő hozamot részben ez is okozta (ld. 1. táblázat 5-8. sor). Meg kell jegyeznem, hogy a kiindulási vegyület, a jód-ferrocén DBU jelenlétében is stabil maradt.
A 2a és 3a termékek alacsony hozamát azonban nem csupán a DBU jelenlétében tapasztalható bomlás okozta. A vékonyréteg-kromatográfiás elemzés 2a és 3a mellett még további két, egy sárga és egy piros színű termék képződését is mutatta.
A melléktermékeket
oszlopkromatográfiás elválasztás után különböző analitikai vizsgálatoknak (1H-
és 13C-NMR, valamint 1H- 1H és 1H-
Az NMR spektrumok két nagyon
hasonló szerkezetű ferrocénvázas vegyület képződését mutatták. Az 1H-NMR
spektrumokban a ferrocénvázhoz tartozó jeleken kívül az 1,4-3,6 ppm
tartományban összesen 16 protonnak megfelelő több multiplett, valamint a piros
vegyület esetében 8,00; a sárga vegyületnél pedig 7,38 ppm-nél egy széles
szingulett található. Az 1H-
A 13C-NMR spektrumok a 8 metilén-jelen és a ferrocénvázhoz tartozó jeleken kívül a piros terméknél 3 (190,9; 176,5 és 162,1 ppm-nél), a sárga terméknél két további jelet (177,2 ppm-nél és 170,2 ppm-nél) tartalmaznak. Az aminok, mint nukleofil reagensek jelenlétében korábban a tanszéken előállított amidok és ketoamidok spektrumait alapul véve [72], a sárga színű vegyület esetén a 170,2 ppm-nél jelentkező jel a ferrocénvázas amidok C=O eltolódásával, míg a piros színű termék esetén 162,1 ppm-es jel a ferrocénvázas ketoamidok amidocsoportjának, 190,9 ppm-nél pedig ketocsoportjának C=O eltolódásával egyezik meg.
Mindezek alapján feltételezhetjük, hogy a két vegyület a ferrocén és DBU reakciójából származó amid-, illetve ketoamid típusú termék.
Az irodalmi adatok alapján a DBU dimetil-karbonát [74], vagy dibenzil-karbonát [75] jelenlétében acilezhető, illetve alkil-halogenidekkel alkilezhető [76]. A termékek a megfelelő sók. Az alkilezésnél vízzel lejátszódó reakcióban egy, a két gyűrűt összekötő híd felnyílásával képződő terméket is kimutattak. Leírtak egy ruténium-komplex jelenlétében lejátszódó acilezési reakciót is, melyben az elsődlegesen képződő só hidroxidion hatására alakul át a végtermékké [77].

2.1. ábra A jód-ferrocén és a DBU karbonilezési körülmények között lejátszódó reakciójának feltételezett lépései
A jód-ferrocén és DBU reakciójában az irodalomban leírt acilezési reakciók alapján a 4a,b só képződését feltételezhetjük, amely utána 5a,b vagy 6a,b termékekké bomolhat, a Ru-komplex jelenlétében lejátszódó, illetve az alkilezési reakcióban tapasztaltak analógiájára.
Az NMR spektrumok a 6a,b termékek képződését valószínűsítik. Ekkor a 8,00; illetve 7,38 ppm-nél található jelek az NH protonok jelei, melyek az 1H-1H korrelációs spektrumok alapján valóban csatolnak a szomszédos metilén-protonokkal. Az NH protonok nagy eltolódása valószínűleg azzal magyarázható, hogy az eredetileg kétgyűrűs vegyület hídja ugyan felnyílik, de hidrogénhíd kötés alakul ki a karbonilcsoport és az aminocsoport H-atomja között.
A termékek szerkezetét a vegyületekről készített tömegspektrumok is bizonyítják, a molekulaion tömege 6a esetében 382-nek, míg 6b-nél 410-nek adódott.
Érdekes megjegyezni, hogy a jód-ferrocén aminokarbonilezése DBU mint nukleofil reagens jelenlétében 6a képződését eredményezte jó szelektivitással, 6b pedig csak nyomokban volt jelen a reakcióelegyben. Ezzel ellentétben a glicin-metil-észter és jód-ferrocén reakciójában DBU jelenlétében kapott melléktermékek fő alkotóeleme 6b volt.
A fenti eredmények alapján elvégeztem a jód-ferrocén karbonilezését glicin-metil-észter (2.1. egyenlet) és négy további aminosav-észter (2.3. egyenlet) jelenlétében az 1. táblázat 2. valamint 6. sorának megfelelő reakciókörülmények között. A DBU bázis hozzáadásával kivitelezett reakciók esetén a termékelegy feldolgozását inert körülmények között is végrehajtottam.

2. táblázat Jód-ferrocén (1) karbonilezése különféle aminosav-észterek jelenlétébena
|
Sorsz. |
Nukleofil reagens |
Bázis |
Konv.b (%) |
Izolált hozam (%) |
||
|
2 |
3 |
6a+6b |
||||
|
1 |
Gly-OMe |
Et3N c |
100 |
94 |
- |
- |
|
2 |
Gly-OMe |
DBU d |
99 |
1 |
25 |
2 |
|
3 |
Gly-OMe |
DBU e |
99 |
1 |
89 |
5 |
|
4 |
L-Ala-OMe |
Et3N c |
92 |
87 |
- |
- |
|
5 |
L-Ala-OMe |
DBU d |
99 |
17 |
20 |
14 |
|
6 |
L-Ala-OMe |
DBU e |
99 |
23 |
28 |
21 |
|
7 |
L-Phe-OMe |
Et3N c |
85 |
81 |
- |
- |
|
8 |
L-Phe-OMe |
DBU d |
97 |
2 |
10 |
29 |
|
9 |
L-Phe-OMe |
DBU e |
96 |
15 |
26 |
42 |
|
10 |
L-Met-OMe |
Et3N c |
81 |
75 |
- |
- |
|
11 |
L-Met-OMe |
DBU d |
98 |
3 |
17 |
19 |
|
12 |
L-Met-OMe |
DBU e |
98 |
4 |
37 |
32 |
|
13 |
L-Pro-OMe |
Et3N c |
90 |
84 |
- |
- |
|
14 |
L-Pro-OMe |
DBU d |
100 |
32 |
29 |
3 |
|
15 |
L-Pro-OMe |
DBU e |
100 |
32 |
30 |
19 |
aReakciókörülmény: jód-ferrocén (0,5 mmol), aminosav-metil-észter hidroklorid (2,5 mmol), Pd(OAc)2 (0,025 mmol), PPh3 (0,05 mmol), 12,5 ml THF, 40 bar CO, 8h bGC alapján (belső standard: eikozán). c Et3N/1=6. d DBU/1=8. e DBU/1=8, a tisztítás során a DBU eltávolítása inert körülmények között történt.
A Et3N bázis jelenlétében lejátszódó reakciókban
DBU jelenlétében változó mennyiségű 6a+6b terméket tudtam elkülöníteni. E kísérletek során csak ezek együttes mennyiségét határoztam meg, mert elválasztásuk csak egy további oszlopkromatográfiás eljárással volt lehetséges.
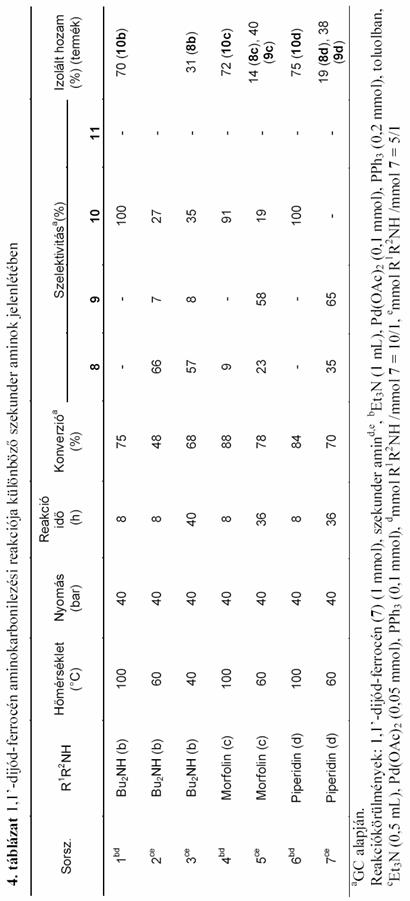
A jód-ferrocén aminokarbonilezési reakciójához hasonlóan vizsgáltam az 1,1'-dijód-ferrocén (7) karbonilezését különböző szekunder aminok jelenlétében. Ez a reakció a korábbihoz képest bonyolultabb, hiszen míg az előző esetben kétféle termék keletkezésével kellett számolni, addig 7 aminokarbonilezése elvileg ötféle vegyület (2.4 egyenlet 8-12) képződéséhez vezethet.

Az 1,1'-dijód-ferrocént 100°C-on, 40bar CO nyomáson az in situ Pd(OAc)2 + 2 PPh3 katalizátor jelenlétében reagáltattam különböző szekunder aminokkal. A korábbi jód-ferrocén aminokarbonilezési vizsgálatok alapján [72] azt vártam, hogy a ketoamid típusú termékek (9, 11, és 12) ezen a hőmérsékleten nem, vagy kis mennyiségben keletkeznek. Kettős karbonilezés lejátszódását valóban nem tudtam kimutatni, de dietil-amin, dibutil-amin és piperidin alkalmazása esetén (3. táblázat 1; 4. táblázat 1, 3, 8 sor) meglepetésemre a dijód-ferrocén részleges átalakulása mellett is csak szelektíven a megfelelő ferrocén-1,1'-dikarboxamid (10a, 10b és 10d) keletkezett, 8 jelenlétét nem tudtam kimutatni. Ez azt jelenti, hogy 100°C-on a második jód szubsztitúciója gyorsabb az elsőnél, ezáltal a 8 vegyület nem tud feldúsulni a termékelegyben, mert rögtön átalakul a 10 diamiddá. Különösen szembetűnő ez a dibutil-amin esetén (4. táblázat 1. sor) ahol 8 óra elteltével a dijód-ferrocén 75%-os átalakulása mellett kizárólag az 1,1'-N,N-dibutil-ferrocéndikarboxamid (10b) jelenlétét tudtam a reakcióelegyben kimutatni. Morfolin nukleofil reagensként való használatakor 8 óra elteltével a ferrocén-dikarboxamid (10c) mellett, mintegy 1/10 részben 1'-jód-morfolino-ferrocénkarboxamid (8c) is jelen volt (4. táblázat 4.sor).
Ezek után azt vizsgáltam, hogy a hőmérséklet csökkentése milyen változásokat okoz a termékelegy összetételében. Az alacsonyabb hőmérsékleten kivitelezett reakció, a vélhető reakciósebesség csökkenések miatt, az 1,1'-dijód-ferrocén részleges szubsztitúciójából eredő termékek (8, 9) arányának növekedését vetíti előre, illetve a korábbi jód-ferrocén aminokarbonilezési tapasztalatok alapján, kettős karbonilezett termékek (9, 11, 12) megjelenése is várható. Az esetlegesen így kapott termékek egyrészt újszerűek, másrészt 8, illetve 9 1'-jód-ferrocén származékok feltételezhetően jó kiindulási anyagai lehetnek egy újabb aminokarbonilezési lépésnek, vagy egyéb heterodiszubsztituált ferrocénszármazékokat eredményező homogénkatalitikus kapcsolásnak. Ezen megfontolások mentén haladva az 1,1'-dijód-ferrocén dietil-amin jelenlétében lejátszódó karbonilezési reakciót vettem górcső alá (3. táblázat).
A hőmérséklet csökkentéssel nem titkolt célom volt, hogy 1'-jód-ferrocén származékokat minél nagyobb mennyiségben szintetizáljak. Mivel így a helyettesítendő jódatomok mennyisége felére csökkent, a katalizátor és a bázis mennyiségét is felére csökkentettem.
A 60°C-on elvégzett kísérlet eredménye igazolta várakozásom helyességét. Nyolc órás reakcióidőt követően ugyan még mindig az 1,1'-N,N-dietil-ferrocéndikarboxamid (10a) dominált, de mellette további három termék (8a, 9a, 11a) jelenlétét is ki tudtam mutatni a termékelegy vizsgálata során (3. táblázat 2. sor). 1,1'-N,N-dietil-ferrocéndiglioxilamid (12a) keletkezését még nyomokban sem tapasztaltam. A kísérletet 50 bar CO nyomáson megismételve 8a és 9a termékek arányának további növekedése figyelhető meg (3. táblázat 3.sor). Ez egyrészt írható a magasabb CO nyomás okozta reakciósebesség csökkenés számlájára (1.5.2.2. fejezet), másrészt a magasabb CO koncentrációból eredően nőhet 9a kettős karbonilezett termék mennyisége. 12a keletkezését továbbra sem tudtam kimutatni. Itt jegyzem meg, hogy a 12 vegyület keletkezését semmilyen más általam kipróbált körülmény, illetve nukleofil reagens esetén sem tapasztaltam.

Visszatérve az általánosan használt 40 bar CO nyomásra tovább csökkentettem a reakció hőmérsékletét. 40°C-on a 8a 1'-jód-ferrocénkarboxamid már tekintélyes arányban van jelen a termékelegyben (3. táblázat 5-10sor), igaz a reakcióidő előrehaladtával ez az arány számottevően csökken az 1,1'-ferrocén-dikarboxamid keletkezésének köszönhetően, de mennyiségét tekintve a 16-ik óráig növekedés tapasztalható, ahol 34%-os elméleti hozammal számolhatunk.
8a hozamának további növelése érdekében az alkalmazott dietil-amin nukleofil reagens arányát csökkentettem. Az 1,1'dijód-ferrocénhez képest tízszeres mennyiségű nukleofil reagens helyett csupán háromszoros felesleget alkalmazva sikerült növelnem 8a mennyiségét. A maximális hozamot 32 óra elteltével értem el (3.táblázat 12.sor), ami a gázkromatográfiás adatok alapján számolva elméletileg 42%-nak adódott. Az oszlopkromatográfiás elválasztás után 35%-os kitermeléssel jutottam a termékhez.
Ezen tapasztalatokra alapozva, egyéb szekunder aminok alkalmazásával igyekeztem további 1'-jód-ferrocénkarboxamidokat, vagy -glioxamidokat előállítani, melyeket egy következő homogénkatalitikus átalakítás során kiindulási anyagként felhasználhatok. A dietil-amin esetén alkalmazott stratégia a legtöbb esetben hatékonynak bizonyult, azonban a szelektivitás területén jelentős eltérések is adódtak (4. táblázat). A dibutil-amin használata során kapott eredmény nem okozott különösebb meglepetést, ugyanis az alacsony hőmérséklet és a csökkentett nukleofil reagens arány mellett megvalósított reakció nagyon hasonló hozamokhoz vezetett (4. táblázat 3.sor), mint azt a dietil-amin esetében tapasztaltam. Morfolin és piperidin alkalmazásakor azonban már jelentős eltérések mutatkoztak. A 60°C-on kivitelezett reakcióban, az eddigiektől eltérően már az 1'-jód-ferrocénglioxamid (9c, 9d) a főtermék, de mellette jelentékeny arányban jelen van az 1'-jód-ferrocénkarboxamid (8c, 8d) is (4. táblázat 5. és 7. sor). Ez utóbbi két esetben közepes hozammal sikerült elkülönítenem az említett kettős karbonilezett származékokat.
Alacsonyabb hőmérsékleten, illetve a nukleofil reakciópartnerként alkalmazott szekunder amin feleslegének csökkentésével sikerült a következő 1'-jód-ferrocénkarboxamidokat, illetve -glioxamidokat közepes hozammal előállítanom: 1'-jód-N,N-dietil-ferrocénkarboxamid (8a), 1'-jód-N,N-dibutil-ferrocénkarboxamid (8b), 1'-jód-morfolino-ferrocénglioxamid (9c), 1'-jód-piperidino-ferrocénglioxamid (9d). A továbbiakban ezek további homogénkatalitikus reakcióit vizsgáltam.
(A 9b és 11a termékeket nem különítettem el, ezeket a vegyületeket a reakcióelegyek GC-MS vizsgálatával azonosítottam. 11b-d képződését nem tapasztaltam.)
A fent említett 1'-jód-ferrocénszármazékok előállításának célja volt, hogy újabb homogénkatalitikus reakciók segítségével heterodiszubsztituált ferrocénszármazékokat szintetizáljak. Az előző fejezetben ismertetett karbonilezési reakciókban legjobb hozammal nyert 1'-jód-származékokat: 8a-t, valamint 9c-t és 9d-t különböző palládium-katalizált reakciók: aminokarbonilezés, NaBPh4 jelenlétében lejátszódó karbonilatív kapcsolás és Stille-kapcsolás segítségével alakítottam tovább. A két homogénkatalitikus lépés viszonylag egyszerű lehetőséget biztosít a két különböző szubsztituenssel helyettesített ferrocénszármazékok, pl. 1,1'-diamidok előállítására szemben az eddig alkalmazott, bonyolultabb módszerekkel (ld. 1.3. fejezet).
Elsőként a 8a amidot reagáltattam karbonilezési
reakcióban különböző szekunder aminokkal (2.5 egyenlet). 40 bar CO nyomáson
100°C-on 8 óra alatt teljes átalakulással megkaptam a megfelelő "vegyes" diamidokat
( 10ab, 10ac, 10ad) (izolált hozam:
92%, 86%, 77%). Kettős karbonilezett termék keletkezését még alacsonyabb
hőmérsékleten (60-

(2.5)
A 8a, 9c és 9d származékok Stille-kapcsolásával vinil-ferrocén származékokat (13a, 14c, 14d) állítottam elő vinil-tributil-sztannán reakciópartner segítségével Pd(PPh3)4 jelenlétében (2.6 egyenlet). A reakciókörülményeket a Szerves Kémia Tanszéken, szteránvázas alkenil-jodidok átalakítása során nyert tapasztalatok alapján [78] választottam meg. A reakció könnyedén lejátszódott, az átalakulás már 3 óra elteltével minden esetben teljes volt.
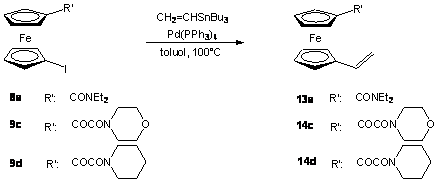
Végül egy - szintén a Pannon Egyetem Szerves Kémia Tanszékén kidolgozott fenil-ketonokat eredményező - karbonilatív kapcsolás [71] révén állítottam elő a 15a származékot (2.7 egyenlet). 8a-t reagáltattam ekvimoláris mennyiségű NaBPh4-al szén-monoxid atmoszférában Pd(PPh3)4 jelenlétében. A reakció előrehaladását gázkromatográfiás úton követtem. 6 óra reakcióidőt követően az átalakulás számottevően már nem változott, ekkor az átalakulás 82% volt. A terméket 78%-os hozammal sikerült elkülönítenem.
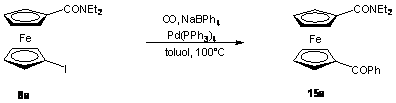
(2.7)
Az eredmények alapján elmondható, hogy a kidolgozott módszer jól alkalmazható változatos szerkezetű ferrocénvegyületek előállítására. Bár az 1'-jód-ferrocénkarboxamid és 1'-jód-ferrocénglioxamid származékok csak közepes hozammal izolálhatók az 1,1'-dijód-ferrocén aminokarbonilezésének termékeiből, a második homogénkatalitikus lépés rendkívül szelektíven és jó hozammal szolgáltatja a kívánt termékeket.
Az előző fejezetben bemutattam, hogyan állítottam elő különböző heterodiszubsztituált ferrocénszármazékokat, köztük a 10ab, 10ac, 10ad diamidokat két lépésben.
Felmerült a kérdés, ilyen típusú vegyületeket nem lehet-e 1,1'-dijód-ferrocénből egy szintetikus lépésben, két különböző nukleofil reagens együttes jelenlétében szintetizálni. A reakciót a kettős karbonilezés elkerülése érdekében 100°C-on kiviteleztem. Egyébként a jód-ferrocén aminokarbonilezésénél optimálisnak talált körülmények között dolgoztam. Ekkor a korábbi tapasztalatok alapján csupán a 2.8 egyenletben feltüntetett három termék - két szimmetrikusan (10x és 10y) és egy nem szimmetrikusan szubsztituált diamid (10xy) - képződésével kellett számolnom.

A karbonilezés előrehaladását gázkromatográfiás úton követtem. Az eredmények azt mutatták, hogy a reakció kimenetele erősen függ a nukleofil reagensként használt aminok természetétől (5. táblázat).
Amikor a kétféle nukleofil reagenst azonos mennyiségben alkalmaztam, a hasonló sztérikus és elektronikus tulajdonságokkal rendelkező aminok esetén, amilyen a dietil-amin - dibutil-amin pár (5. táblázat 1. sor), a termékek a statisztikailag várható 10ab / 10a / 10b = 2 / 1 / 1 arányban keletkeztek, ilyen esetekben a vegyes amidok (10xy) aránya nem növelhető. A többi vizsgált amin pár hasonló körülmények között lejátszódó reakciójában általában a nem szimmetrikusan szubsztituált vegyület (10xy) mellett csak az egyik szimmetrikus diamid képződött (5. táblázat 2., 7., 8., 10. és 12. sor). Kivételt képez a piperidin jelenlétében lejátszódó két reakció, ahol a piperidin olyan sikeresen verseng a dietil-aminnal (5. táblázat 4.sor) vagy a dibutil-aminnal (15. sor), hogy mindkét reakcióelegyben kizárólag 10c jelenlétét figyeltem meg. Külön ki kell emelnem a dietil-amin és morfolin valamint a dibutil-amin és morfolin jelenlétében lejátszódó aminokarbonilezést (5. táblázat 7. és 10. sor), ahol a két amin 1/1 arányú elegyének
5. táblázat 1,1'-dijód-ferrocén karbonilezése két különböző amin együttes jelenlétében
|
Sorsz. |
R1R2NH (x) |
R3R4NH (y) |
R1R2NH / |
Reakcióidő |
Konv.(%) |
szelektivitás(%) (izolált hozam) (%) |
||
|
R3R4NH |
(h) |
10xy |
10x |
10y |
||||
|
|
HNEt2 (a) |
HNBu2 (b) |
|
|
|
|
|
|
|
|
HNEt2 (a) |
morfolin (c) |
|
|
|
|
|
|
|
|
HNEt2 (a) |
piperidin (d) |
|
|
|
|
|
|
|
|
HNEt2 (a) |
piperidin (d) |
|
|
|
|
|
|
|
|
HNEt2 (a) |
piperidin (d) |
|
|
|
|
|
|
|
|
HNEt2 (a) |
H2NBu (e) |
|
|
|
|
|
|
|
|
HNEt2 (a) |
H2NBu (e) |
|
|
|
|
|
|
|
|
HNBu2 (b) |
H2NBu (e) |
|
|
|
|
|
|
|
|
HNBu2 (b) |
H2NBu (e) |
|
|
|
|
|
|
|
|
HNBu2 (b) |
H2NBu (e) |
|
|
|
|
|
|
|
|
morfolin (c) |
piperidin (d) |
|
|
|
|
|
|
|
|
morfolin (c) |
piperidin (d) |
|
|
|
|
|
|
|
|
morfolin (c) |
H2NBu (e) |
|
|
|
|
|
|
|
|
morfolin (c) |
H2NBu (e) |
|
|
|
|
|
|
|
|
morfolin (c) |
H2NBu (e) |
|
|
|
|
|
|
aGC alapján; Reakciókörülmény: 1,1'-dijód-ferrocén (7) (1 mmol), R1R2NH + R3R4NH (10mmol), Et3N (1 mL), Pd(OAc)2 (0,1 mmol), PPh3 (0,2 mmol), toluolban
alkalmazásakor is 90, illetve 88%-os szelektivitással képződött a heterodiszubsztituált vegyület (10ac és 10bc). A többi esetben a dietil-amin dibutil-amin reagens pár kivételével a kevésbé reakcióképes amin arányának növelésével sikerült a nem szimmetrikusan szubsztituált származékok képződését növelni (5. táblázat 2.-15. sor).
Úgy tűnik azonban, hogy nem kizárólag az aminok reakciókészsége, vagy bázicitása befolyásolja az aminokarbonilezés szelektivitását. Jól szemlélteti ezt a következő kísérlet. Jód-ferrocént reagáltattam ekvimoláris mennyiségű, jód-ferrocénre nézve egyenként ötszörös feleslegben lévő morfolin és dietil-amin elegyével aminokarbonilezési körülmények között 100°C-on (2.8).

A két termék: az N,N-dietil-ferrocénkarboxamid (16a) és a morfolino-ferrocénkarboxamid (16c) 1/7 arányban keletkezett. Ez alapján úgy tűnik, hogy annak ellenére, hogy a morfolin bázicitása kisebb, mint a dietil-aminé, mégis nagyobb a reakciókészsége. Ha azonban ugyanezen amin pár szintén 1/1 arányú elegyét 1,1'-dijód-ferrocénnel reagáltatjuk, azt tapasztaljuk, hogy 10c nem keletkezik (5. táblázat 2. sor) annak ellenére, hogy az előző reakció alapján a morfolin tűnt reakcióképesebbnek. Valamilyen oknál fogva a morfolinnal képződő szimmetrikus diamid keletkezése kedvezőtlen. Némileg egybevág ezzel a megfigyeléssel a 2.3. fejezetben leírt tapasztalat, melyben azt láthatjuk (4. táblázat), hogy az 1,1'-dijód-ferrocén szekunder aminok jelenlétében lejátszódó aminokarbonilezési reakcióiban 100°C-on kizárólag a megfelelő ferrocén-diamid keletkezik, kivéve a morfolin esetében, ahol ugyanannyi idő elteltével 1'-jód-ferrocén-karboxamid jelenléte is megfigyelhető volt (4. táblázat 4. sor).
Más aminok morfolinnal egyidejű alkalmazásakor is hasonló eredményt tapasztaltam, mint dietil-amin esetén, ami szintén azt mutatja, hogy a morfolinnal képződő szimmetrikus diamid keletkezése némileg gátolt (5. táblázat 11.-14. sor. ).
Nagyon sok reakcióban tehát a két amin arányának megfelelő megválasztásával elérhető, hogy a nem szimmetrikus 1,n'-ferrocéndikarboxamidok aránya messze a legmagasabb legyen. Így ez az eljárás egy meglehetősen egyszerű és hatékony alternatívát kínál e vegyületek szintézisére (vö. 1.10 egyenlet).
Mint azt a 1.2. fejezetben láthattuk, a ferrocén amidokat előszeretettel alkalmazzák különböző kémiai szenzorokként, molekula- és ionreceptorokként. Ezen alkalmazásoknál nagyon sokszor kulcsszerepet játszik a receptor (ferrocén származék) és a "vendég"molekula, vagy ion között kialakuló hidrogénkötés. Megfelelő szubsztituensek esetén magán a ferrocén származékon belül is kialakulhatnak hidrogénkötések, melyek döntően befolyásolják a molekula szerkezetét, viselkedését. Ezen hidrogénhidak jelentőségét tekintve nem meglepő, hogy számos kutatócsoport írta le megfigyeléseit ezzel kapcsolatban. [24, 79-81]
Az
előzőekben bemutatott módszerek segítségével előállított diamidok (2.2 ábra) 1H-NMR
spektrumainak vizsgálatakor magam is számos érdekes megfigyelésre jutottam. Az egy
N-szubsztituált és egy N,N-diszubsztituált amidocsoportot
tartalmazó (10ae, 10be, 10ce), illetve a két N,N-diszubsztituált
amidocsoportot tartalmazó diamidok (10ac,
10ab, 10ad, 10cd, 10a, 10b, 10c, 10d) spektrumának összehasonlításában az
egyik szembetűnő és nyilvánvaló eltérés az előbbiekben az NH proton jelenléte,
amely 8 ppm fölötti tartományban található (6. táblázat 1-3 sor). Az amid NH
protonjának ilyen magas kémiai eltolódása 10ae,
10be, 10ce esetében hidrogénkötés létrejöttére utalhat. A másik
figyelemre méltó eltérés a két N,N-diszubsztituált
amidocsoportot tartalmazó "vegyes" diamidok (10ab, 10ac, 10ad, 10cd) spektrumával összehasonlítva a ferrocén váz Cp potonjaiban
mutatkozott. Ezen diamidok ciklopentadienil gyűrűinek 2,5; 3,4;
![]()
protonjaival. Ebből az látszik,hogy az egyik ciklopentadienil gyűrűn lévő szubsztituens nincs befolyással a másik Cp gyűrű protonjaira. Merőben más a helyzet azonban az egy N-szubsztituált és egy N,N-diszubsztituált amidocsoportot tartalmazó diamidok esetében. A 10ae, 10be, 10de vegyületek 1H-NMR spektrumát vizsgálva az előbb tárgyalt tartományban, a jelek összeolvadását figyelhetjük meg. Elvégezve az iménti összehasonlítást pl. 10ae és a megfelelő szimmetrikus diamidok (10a és 10e) között, a következő eltolódásokat láthatjuk: 10ae spektrumában: 4,60(s, 2H); 4,36(brs, 4H) és 4,32(s, 2H), 10a spektrumában: 4,63(s, 4H); 4,36(s, 4H) és 10e spektrumában: 4,46(s, 4H); 4,30(s, 4H) a ciklopentadienil gyűrűk protonjainak eltolódása. Az adatokból jól látható az eltérés, amely a későbbi vizsgálatok alapján úgy tűnik, hogy szintén az intramolekuláris hidrogénhíd létrejöttének köszönhető.
6. táblázat 1,1'-Ferrocén-bisz-karboxamidok jellemző spektroszkópai adatai
|
Sorsz. |
|
nNHa (cm-1) |
Amid-Ia (cm-1) |
Amid-IIa (cm-1) |
dNHc (ppm) |
dCpc (ppm) |
|
|
10ae |
|
1613 |
|
|
|
|
|
10be |
|
1610 |
|
|
|
|
|
10ce |
|
|
|
|
|
|
|
10ab |
|
|
|
|
|
|
|
10ac |
|
|
|
|
|
|
|
10ad |
|
|
|
|
|
|
|
10cd |
|
|
|
|
|
|
|
10a |
|
|
|
|
|
|
|
10b |
|
|
|
|
|
|
|
10c |
|
|
|
|
|
|
|
10d |
|
|
|
|
|
|
|
10e |
|
|
|
|
|
aIR (KBr)
b 1H-NMR (400MHz,CDCl3)
Mindezen figyelemre méltó megfigyelések arra sarkalltak, hogy a 10ce vegyületet részletes spektroszkópiai vizsgálatoknak vessem alá mind szilárd, mind pedig oldott állapotban.
Munkám során a keletkezett termékből több ízben próbáltam egykristályt növeszteni. Egyedül 10ce-t sikerült diklór-metán-dietil-éter oldószerelegyből szerkezetvizsgálatra alkalmas egykristály formájában kinyernem. A molekula szerkezetét a Debreceni Egyetem Kémiai Tanszékcsoportjának röntgenkrisztallográfiai laboratóriumában Dr. Bényei Attila határozta meg. A kapott kötéstávolság és kötésszög értékekből a kristályszerkezet az ORTEP és WINGX-97 programcsomag segítségével készült el (2.3 ábra).
A H42.O1 2,18(5) Ǻ és az N42.O1 2,933(6) Ǻ atomok közötti kötéstávolság, illetve az N42-H42.O1 174(4)° kötésszög jól jellemzi a molekulában kialakult erős intramolekuláris hidrogénkötést. A ferrocén molekularészlet központi vasatomja és a hozzá koordinálódó ciklopentadienil szenek Fe-C távolsága 2,010-2,050 Ǻ, ez rövidebb az adatbázisokban egyéb ferrocénszármazékoknál található 2,080 Ǻ értéknél [82, 83]. A molekula szerkezetét tovább stabilizálja az O1 illetve O41 atomok és a morfolin valamint a Cp gyűrű térben közel kerülő hidrogénatomjai között kialakuló gyenge hidrogénkötés.
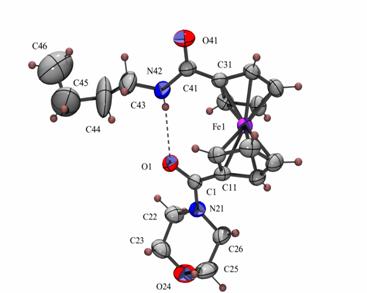
2.3. ábra 10ce vegyület röntgendiffrakciós szerkezetének ORTEP rajza
kötéstávolság (Ǻ), kötésszög(°): Fe-C 2,013-2,052; C1-O1 1,237(5); C1-C11 1,494(5); C1-N21 1,339(5); C31-C41 1,469(5); C41-O41 1,235(5); C41-N42 1,318(6); N42-C43 1,463(7); O1-N42 2,938(5); N42-H42-O1 174(6)
A 10ce KBr pasztilla segítségével felvett infravörös spektrumán 3252 cm-1-nél található a n(NH) vegyértékrezgési sáv. 1642 cm-1-nél találjuk a hidrogénhídban nem szereplő C=O és 1593 cm-1-nél az amid NH-val hidrogénkötésben lévő C=O vegyértékrezgési sávjait, az úgynevezett amid-I sávokat egyenlő intenzitással. Az amid-I sáv nagyobb részben a C=O vegyértékrezgésből, kisebb részben ugyan, de a C-N vegyértékrezgésből is ered és 1800-1630 cm-1 intervallumban jelenik meg. Pontos helye az amidocsoport szubsztituenseitől függ, de tudjuk, hogy a karbonilcsoport oxigénjével kialakuló hidrogénhidak csökkentik az amid-I sáv helyét. 1552 cm-1-nél jelenik meg az amid-II sáv, melyben a síkban deformációs NH rezgésmód dominál, de C-N vegyértékrezgésmód is jelentős szerepet játszik.
A szilárd fázisú vizsgálatok megbízhatóan igazolták a molekula két szubsztituense között kialakult hidrogénkötést. A molekula oldott állapotban lévő szerkezetének tisztázását infravörös és 1H-NMR spektroszkópiai módszerek segítségével végeztem el.
Irodalmi adatok szerint hidrogénkötésben részt nem vevő amid NH csoportok nNH vegyértékrezgési sávja 3400 cm-1 fölötti hullámszám tartományban jelentkezik a molekula infravörös spektrumában, kémiai eltolódása pedig 5,5 és 7,5 ppm között található az 1H-NMR spektrumon. Ugyanakkor ha az amid NH hidrogénkötésben van, a nNH vegyértékrezgési sáv 3400 cm-1 alatt, míg protonjának jele 7,5 ppm fölötti kémiai eltolódásnál keresendő. Mindezek mellett az NH protonok kémiai eltolódásának kis mértékű (-2 - -4 ppb K-1) hőmérsékletfüggése (ΔδH) jelentheti egyrészt hidrogénhíd hiányát, illetve annak erős mivoltát. Ezen irodalmi megfigyeléseket [80] alapul véve végeztem el 10ce oldat fázisú szerkezetvizsgálatát.
10ce diklórmetán oldatban felvett IR spektrumán két különböző nNH vegyértékrezgési sáv található, egy gyengébb 3488 cm-1-nél és egy erősebb sáv 3272 cm-1-nél. Ennek magyarázata a kétféle - hidrogénkötésben lévő és szabad - amid NH egyidejű jelenléte oldott állapotban. Értelemszerűen a nagyobb hullámszámnál jelentkező jel tartozik a hidrogénhíd mentes formához (2.9 egyenlet B szerkezet), míg az alacsonyabb hullámszámú sáv a hidrogénhidas forma (2.9 egyenlet A szerkezet) létezését támasztja alá. Ez utóbbi sáv nagyobb intenzitása jelzi az A szerkezet dominanciáját az adott körülmények között.
A hidrogénkötés jelenléte jól megfigyelhető a karbonilcsoport jellemző vegyértékrezgési sávjainak megfelelő hullámszámtartományban (amid-I sáv) is. A karbonilcsoport oxigénjével kialakult hidrogénhidak jelentősen csökkentik a C=O vegyértékrezgési sáv hullámszámát. Ennek megfelelően két n(C=O) vegyértékrezgési, vagy amid-I sávot látunk az oldat IR spektrumán. Egy intenzívebb, szélesebb sávot 1646 cm-1-nél, amely megfelel az A forma hidrogénhídban részt nem vevő CO, illetve a B forma mindkét karbonilcsoportjának. Körülbelül 30 cm-1-rel alacsonyobb hullámszámnál, 1614 cm-1-nél találjuk az A forma hidrogénhidas karbonilcsoportjának jelét. Az A és B forma együttes jelenlétének megfelelően az amid-II sávokból is kettőt találunk, egyenként 1548 és 1523 cm-1-nél.
10ce NH protonjának kémiai eltolódása 30°C-on deutero-kloroformban 8,32 ppm, toluol-d8-ban 8,47 ppm. A toluolos oldat 15-szörös hígítása az NH proton kémiai eltolódásának csupán 0,02 ppm-es csökkenését idézte elő, ami valószínűsíti a feltételezett intramolekuláris kölcsönhatás létrejöttét a molekula két szubsztituense között. Az NH proton helyének hőmérsékletfüggését vizsgálva toluolban, 303-353 K között, a ΔδH = -14,3 ppb K-1-nek adódott, amely egy közepesen erős dinamikus hidrogénkötésnek felel meg.
Mivel az irodalom a ferrocénkarbonsav-amidokat és -diamidokat kiváló anion receptorokként tartja számon, kézenfekvő volt, hogy 10ce infravörös és 1H-NMR vizsgálatait kloridion jelenlétében is elvégezzem. Az anionok hidrogén akceptor sajátságát figyelembe véve, kloridionok jelenléte várhatóan erős befolyást gyakorol az intramolekuláris hidrogénhíd kialakulására, illetve megszűnésére (2.9. egyenlet).
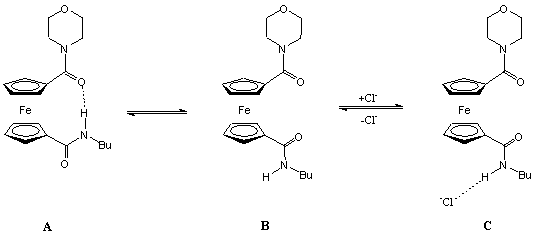 (2.9)
(2.9)
n(NH) 3272 cm-1 3448 cm-1 3285 cm-1
amid-I 1646, 1614 cm-1 1646 cm-1 1654, 1642cm-1
amid-II 1548 cm-1 1523 cm-1 1548 cm-1
A tetra-n-butil-ammónium-klorid formájában hozzáadott kloridion valóban markáns változásokat idézett elő mind az infravörös, mind pedig az 1H-NMR spektrumokban (7. táblázat). A szabad amid NH 3448 cm-1-es vegyértékrezgési sávjának eltűnése mellett az amid-I sávok hasadását tapasztaltam. Négyszeres kloridion felesleget elérve ez utóbbi jelek szélesedése, egybecsúszása miatt alkalmatlanná váltak a molekulaszerkezet változásainak precíz követésére. Az 1550 cm-1 körül jelentkező hidrogénkötésben résztvevő amid amid-II sávjának intenzitásnövekedése mellett a szabad forma (B) amid-II sáv-intenzitásának folyamatos csökkenését figyeltem meg, ami szintén a B → C átalakulás lejátszódására utal.
A kloridion-koncentráció növelésének hatására a 1H-NMR felvételeken is ugyanaz a tendencia figyelhető meg, mint az infravörös spektrumokon. Az NH proton kémiai eltolódásának növekedése jelzi, hogy egyre több NH proton vesz részt hidrogénhíd kialakításában (B → C forma). Ezen túlmenően magas kloridion koncentrációnál a Cp protonok az addig megfigyelt három szingulett helyett négy jellé különülnek. Ez a jelenség valószínűleg az intramolekuláris hidrogénhíd helyett kialakuló intermolekuláris hidrogénhíd megjelenésének köszönhető (C forma). A C szerkezetben a két gyűrű szubsztituensei ismét "függetlenek" egymástól, ugyanúgy, mint a kizárólag N,N-diszubsztituált amid csoportot tartalmazó diszubsztituált ferrocénszármazékok esetén, ahol nincs lehetőség intramolekuláris hidrogénhíd képződésére.
Említést érdemel, hogy a két N-szubsztituált amidocsoportot tartalmazó ferrocénszármazék (10e) spektrumaiban oldott állapotban hidrogénhíd kialakulására utaló jelet - csakúgy mint mások [24] - nem tapasztaltam.
7. táblázat 10ce jellemző infravörös és 1H-NMR spektroszkópiai adatai kloridion jelenlétében
|
Cl- / 10ce |
nNHa (cm-1) |
Amid-Ia (cm-1) |
Amid-Iia (cm-1) |
dNHc (ppm) |
dCpc (ppm) |
|
|
3252b |
1640, 1593b |
1552b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a c(10ce)=3x10-2M, diklór -metánban 25°C-on b Szilárd fázisú, KBr-ben c c(10ce)=5x10-2M CDCl3-ban 30°C-on
A ferrocénszérmazékokat stabilitásuk, kedvező elektrokémiai tulajdonságai miatt előszeretettel alkalmazzák elektrokémiai bioszenzorok építőkövének (1.2.2. fejezet). Ennek következtében számos módszert dolgoztak ki különböző biomolekulák ferrocénvázhoz való csatolására [84]. Ezen molekulák közül is kitüntetett érdeklődés övezi az 1,n'-diszubsztituált ferrocenoil-aminosavakat és peptideket, melyek még oldott állapotban is viszonylag rendezett molekulaszerkezettel rendelkeznek [85, 86]. Az ilyen diszubsztituált ferrocénszármazékok két ciklopentadienil gyűrűjéhez túlnyomó többségben két azonos aminosav, vagy peptid kapcsolódik. A legritkább esetben találkozunk olyan heterodiszubsztituált ferrocenoil-aminosav, vagy peptid származékokkal, melyekben a ferrocén ciklopentadienil gyűrűi két különböző aminosav, vagy peptid származékkal helyettesítettek. Ennek oka valószínűleg az eddig alkalmazott szintézisek összetettségében, bonyolultságában keresendő. Mindössze három példát találtam az irodalomban ilyen heterodiszubsztituált származékok előállítására, melyeket az 1.4 fejezetben tárgyaltam.
Tekintetbe véve az említett vegyületcsalád mind szimmetrikusan helyettesített, mind heterodiszubsztituált képviselőinek jelentőségét, lényeges lehet egy egyszerű, a korábbiaknál hatékonyabb előállítási mód kidolgozása. Az általam alkalmazott homogénkatalitikus palládium-katalizált aminokarbonilezés ennek megoldására kínál egy elegáns lehetőséget.
A
korábbi kutatási eredményeimre támaszkodva a 2.10 egyenletnek megfelelően
1,1'-dijód-ferrocént (7)
aminokarbonilezési reakcióba vittem két különböző aminosav-észtert ekvimoláris
mennyiségben tartalmazó eleggyel. Katalizátorként a jól bevált Pd(OAc)2
és két ekvivalens trifenil-foszfán elegyét használtam. A karbonilezésnél 40 bar
szén-monoxid nyomást és
(Meg kell jegyeznem, hogy az aminokarbonilezés minden valószínűség szerint alkalmas a szimmetrikus 17a-d származékok szelektív szintézisére egyetlen aminosav-észter reakciópartner alkalmazása esetén. Az én célom a heterodiszubsztituált vegyületek előállítása volt, tehát az egyetlen nukleofil reagens jelenlétében lejátszódó karbonilezést nem vizsgáltam. A 17a-d vegyületek mint melléktermékek képződtek, ezért ezekre a vegyületekre hozamokat nem adtam meg a 4. fejezetben.)
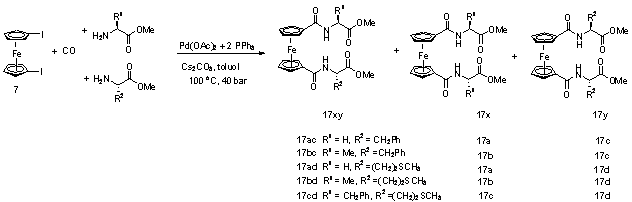
(2.10)
Az esetek többségében a heterodiszubsztituált ferrocénkarbonsav származékok és a szimmetrikusan helyettesített társaik körülbelül a statisztikailag várt 17xy:17x:17y = 2:1:1 arányban keletkeztek (6. táblázat 2-4 sor). Ettől az eredménytől némileg eltér a glicin-metil-észter-fenilalanin-metil-észter nukleofil reagenspár használatakor kapott termékarány. A glicin-metil-észterből képződött szimmetrikus ferrocenoil aminosavészter származék Fe[C5H4-CO-Gly-OMe]2 (17a) mennyisége valamiért alul marad fenilalanin-metil-észterrel képződött párjáétól Fe[C5H4-CO-Phe-OMe]2 (17c), ugyanakkor a kívánt heterodiszubsztituált származék [MeO-Phe-CO-C5H4-]Fe[C5H4-CO-Gly-OMe] (17ac) részaránya itt a legnagyobb (8. táblázat 1.sor).
8. táblázat Az 1,1'-dijód-ferrocén (7) és két különböző aminosav-észter reakciójában kapott termékek (17) hozama
|
Sorsz. |
Termék Hozam (%) |
||
|
|
17xy |
17x |
17y |
|
|
17ac 47 |
17a 8 |
13c 24 |
|
|
17bc 27 |
17b 13 |
17c 13 |
|
|
17ad 39 |
17a 24 |
17d 19 |
|
|
17bd 40 |
17b 18 |
17d 16 |
|
|
17cd 52 |
17c, |
17d 19 |
Reakciókörülmények: 1,1'-dijód-ferrocén (7) (0,5 mmol), Pd(OAc)2 (0,05 mmol), PPh3
(0,1 mmol), két különböző aminosavészter-hidroklorid (2 x 0,6 mmol), Cs2CO3
(2,2 mmol), toluol (10 mL),
Bár a reakcióban három, egymáshoz nagyon hasonló szerkezetű termék képződik, a komponensek oszlopkromatográfiás módszerrel szétválaszthatók (szilikagél, toluol-metanol, 7:1). A 8. táblázat izolált hozam adatai alapján elmondható, hogy a szóban forgó eljárás heterodiszubsztituált 1,1'-ferrocenoil-bisz-aminosav-észterek előállításának egy meglehetősen egyszerű módja.
Korábbi közlemények ilyen típusú ferrocéndikarboxamid származékok rendezett szerkezetéről számolnak be, melyet a két szemközt lévő észter C=O és amid NH csoportok között kialakult 1-1 intramolekuláris hidrogénhíd stabilizál (2.4 ábra) [24, 80, 81, 87].

2.4 ábra
Az általam előállított új vegyületek 17ac, 17cd, 17ad és 17bd esetében az infravörös és 1H-NMR spektroszkópiai adatok: az NH protonok viszonylag magas, 7,5 ppm fölötti eltolódása, illetve a 3400 cm-1 alatt jelentkező nNH vegyértékrezgési sáv, szintén az előbb vázolt szerkezet kialakulását támasztja alá.
A módszer továbbfejlesztésével lehetőség nyílhat tetszőleges, akár két különböző peptidlánc kiépítésére a ferrocén két ciklopentadienil gyűrűjén. Amennyiben két eltérő védőcsoporttal rendelkező aminosav-észtert alkalmazunk az aminokarbonilezési reakció nukleofil reakciópartnereként, úgy a kapott vegyes ferrocéndikarboxamid származékok eltérő módon védett aminosav láncai különböző módszerekkel egyenként hidrolizálhatóak, illetve aktiválhatóak.
Az eddigiekben a heterodiszubsztituált 1,1'-ferrocén származékok előállításának két homogénkatalitikus lehetőségét mutattam be. A ferrocén Cp gyűrűinek nagy reakcióképessége miatt lehetőség van arra is, hogy egyszerű, klasszikus szerves kémiai módszerek bevonásával könnyedén heterodiszubsztituált ferrocénszármazékokhoz jussunk. Így állítottam elő az Eötvös Lóránd Tudományegyetem Peptidkémiai Kutatócsoportjával és Szervetlen Kémiai Tanszékével való együttműködés keretein belül N-ferrocenoil-glicin-metil-észter (2a) Friedel-Craft acilezésével 1'-acetil-N-ferrocenoil-glicin-metil-észtert (18) (2.11 egyenlet).
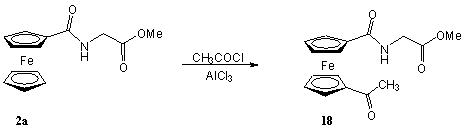
(2.11)
A szintézis második lépését Eisenthal módszere szerint hajtottam végre [88], melynek eredményeként a teljes átalakulásnak köszönhetően egy egyszerű feldolgozást követően, tisztán kaptam meg a kívánt acilezett ferrocénszármazékot (18) (hozam: 99%).
A karbonilezési reakciók kiindulási anyagaként szolgáló jód-, illetve dijód-ferrocén előállításához felhasznált ferrocén a Flukától, a jód a Reanaltól származott, míg a n-butil- és t-butil-lítium oldatok Aldrich márkájú anyagok voltak.
A homogénkatalitikus
karbonilezésben használt katalizátor prekurzor palládium-acetát és trifenil-foszfán
a Fluka által forgalmazott vegyszer volt. Az egyéb kapcsolási reakciók
katalizátoraként szolgáló Pd(PPh3)
A reakciókban bázisként alkalmazott trietil-amin Carlo Erba, a cézium-karbonát Aldrich termék volt. A trietil-amint felhasználás előtt argon alatt átdesztilláltam és inert körülmények között tároltam. A nukleofil reagensek közül az aminok Fluka vegyszerek voltak, az aminosavésztereket szintén Fluka gyártmányú aminosavakból, tionil-kloriddal (Reanal) és metanollal készítettem.
A Stille-kapcsolás vinil-tributil-sztannán reagense Aldrich, a NaBPh4-os kapcsolás reagense Fluka, az N-ferrocenoil-glicin-metil-észter acilezési reakciójában használt alumínium-klorid Fluka, az acetil-klorid Reanal reagens volt.
A ferrocénvázas termékek szétválasztására szolgáló oszlopkromatográfiás eljárás során állófázisként alkalmazott alumínium-oxid (BrockmannII, neutrális) Spektrum 3D Kft. által forgalmazott anyag.
A reakcióelegyek feldolgozása során használt sósav, nátrium-hidrogén-karbonát és nátrium klorid oldatokat szintén Spektrum 3D-s vegyszerekből készítettem.
A kísérlethez használt oldószerek Fluka, Reanal és Spektrum 3D analitikai tisztaságú vegyszerek voltak.
A legtöbb reakció oldószereként használt toluolt az analitikai tisztaságú oldószer argon alatti desztillációjával készítettem, benzofenon és fém nátrium segítségével.
A kísérleti munka folyamán a vegyszerek, oldószerek beméréséhez és a reakciótérhez, mint inert rendszerhez szükséges feltételek biztosítására szolgáló argon gázt a Messer Hungarogáz Kft. forgalmazta. Közvetlenül a használat előtt az argonból "DEDUX" töltetű oszlopon a nyomokban lévő oxigént eltávolítottam, valamint a gázt szilikagéllel és kálium-hidroxiddal töltött csöveken keresztülvezetve szárítottam.
A karbonilezési reakcióhoz szükséges szén-monoxid szintén a Messer-Hungarogáz Kft. terméke volt.
Gázbevezetővel,
szeptumos feltéttel és csepegtetőtölcsérrel ellátott reaktorba bemértem 15 mmol
(
Az
1 órás keverés közben egy Schlenk edénybe bemértem
Az 1 órás 0°C-os keverést követően a reakcióelegyet cseppfolyós nitrogén - aceton eleggyel -78°C-ra hűtöttem és ezen a hőmérsékleten cseppenként hozzáadtam a jódoldatot kb. 40 perc alatt. Ezt követően a reakcióelegyet további 1 órán át kevertem, majd a hűtőfürdő eltávolítása után hagytam a reakcióelegyet szobahőfokra melegedni.
A reakció végén az elegyhez 100 ml vizet adtam a feleslegben maradt t-BuLi reagens elbontása érdekében, majd választótölcsér segítségével elkülönítettem a szerves és a vizes fázist. Ezután a vizes fázist 30 ml dietil-éterrel 3 ízben extraháltam. A szerves fázisokat egyesítettem és mostam vízzel, telített Na2S2O3 és telített NaCl oldattal. Ezután a szerves fázist Na2SO4-al szárítottam, majd az oldószert vákuumdesztillációval eltávolítottam.
A tiszta jód-ferrocént a maradék ferrocén szennyezéstől oszlopkromatográfiával választottam el. Állófázisként Brockmann-II, neutrális alumínium-oxidot használtam, a kromatográfia eluense n-hexán volt.
Egy gázbevezetővel, szeptumos feltéttel és csepegtetőtölcsérrel ellátott reaktort argon alá helyeztem majd a szeptumos feltéten keresztül bemértem 24,6 mmol (3,7 ml) tetrametil-etilén diamint (TMEDA). Ehhez hozzáadtam a szeptumon keresztül 3,4 ml n-hexánt. Ezután a csepegtetőtölcsér segítségével szobahőmérsékleten, keverés közben cseppenként hozzáadtam 24,6 mmol n- BuLi-ot 1,5 M-os pentános oldat formájában (15,3 ml). A beadagolás befejeztével az elegyet további 10 percig szobahőfokon kevertem.
Ezalatt
egy Schlenk edénybe bemértem 10 mmol (
A 10 perces keverés elteltével az előzekben elkészített ferrocén hexános oldatát a csepegtető tölcsér segítségével hozzáadtam a n-BuLi-TMEDA komplex oldatához. A dilítium vegyület kialakításához a reakcióelegyet szobahőfokon 6 órán át kevertem.
Ezalatt,
egy újabb Schlenk edénybe bemértem 40 mmol jódot (
A 6 órás keverést követően a reakcióelegyet aceton és cseppfolyós nitrogén elegyével -78°C-ra hűtöttem. A előzőekben elkészített jód oldatot a csepegtetőtölcsér segítségével hozzáadtam a -78°C-os reakcióelegyhez, majd további fél órán át ezen a hőfokon kevertem. A hűtőfürdőt eltávolítva a reakcióelegyet keverés közben szobahőmérsékletűre melegedni.
A reakcióelegyet a jód-ferrocén előállításánál elvégzett feldolgozási eljárással megegyező módon dolgoztam fel.
A tiszta 1,1'-dijód-ferrocént a maradék ferrocéntől és a melléktermékként keletkező jód-ferrocéntől oszlopkromatográfiával választottam el. Állófázisként Brockmann-II, neutrális alumínium-oxidot használtam, a kromatográfia eluense n-hexán volt.
NaCl-os jeges hűtés közben -5°C-on egy 100 cm3-es gömblombikba 30 ml metanolhoz cseppenként hozzáadtam 0,11 mol tionil-kloridot. 10 perc keverés után spatulányi adagokban hozzáadtam 0,1 mol aminosavat, majd újabb 15 percig kevertem. Ezután a sólé fürdőt vízfürdőre cseréltem és 40°C-on kb. 2 órán át kevertem. Ezt követően a metanolt ledesztilláltam a reakcióelegyről. A lepárolt reakcióelegyet vízben oldottam és NH4OH oldattal semlegesítettem, majd a vizes oldatot szilárd nátrium-kloriddal telítettem. A NaCl-al telített vizes oldatból többszöri izopropil-alkoholos extrakcióval nyertem ki az aminosav-metilészter-hidrokloridot.
Egy saválló autoklávba inert körülmények között bemértem 0,5 mmol jód-ferrocént, 0,025 mmol Pd(OAc)2-t, 0,05 mmol PPh3-t, 2,5 mmol aminosav-észter-hidrokloridot, a táblázatokban megadott mennyiségű bázist és 12,5 ml vízmentes toluolt vagy THF-et. Ezután az autokláv reakcióterét a kívánt szén-monoxid nyomás alá helyeztem és a megfelelő hőmérsékletű olajfürdőben mágneses keverő segítségével kevertem. A reakció előrehaladtát vékonyrétegkromatográfiás, illetve gázkromatográfiás módszerekkel követtem.
A reakcióelegyből leszűrtem a kivált fém palládiumot, majd vákuumdesztilláció segítségével eltávolítottam az oldószert. A desztillációs maradékot 20 ml dietil-éterben feloldottam, ezt az oldatot 2x20 ml 5%-os H3PO4 oldattal, majd 20 ml telített NaHCO3 oldattal, végül 20 ml telített NaCl oldattal mostam. Az extrakciós lépések után az éteres fázist vízmentes Na2SO4-tal szárítottam, majd a szárítószert kiszűrtem és az étert desztillációval eltávolítottam. Feldolgozás után a terméket oszlopkromatográfiával tisztítottam. Állófázisként Al2O3-ot, eluensként toluol/EtOAc 2/1 arányú elegyét használjuk. A 6a és 6b termékeket szintén Al2O3 oszlopon, EtOAc/MeOH 10/1 eleggyel választottam szét.
Egy saválló autoklávba inert körülmények között bemértem 0,5 mmol 1,1'-dijód-ferrocént, 0,05 mmol Pd(OAc)2-t, 0,1 mmol PPh3-t, megfelelő mennyiségű primer és/vagy szekunder amint/aminokat, bázisként hozzáadtam 500 ml trietil-amint és oldószerként 25 ml vízmentes toluolt használtam. Ezután az autokláv reakcióterét a kívánt szén-monoxid nyomás alá helyeztem és a megfelelő hőmérsékletű olajfürdőben mágneses keverő segítségével kevertem. A reakció előrehaladtát vékonyrétegkromatográfiás, illetve gázkromatográfiás módszerekkel követtem.
A reakció befejeztével a reakcióelegyet mostam 5%-os H3PO4 oldattal, telített NaHCO3 oldattal, végül telített NaCl oldattal. A szerves fázist Na2SO4-al szárítottam, az oldószert vákuumban ledesztilláltam. A keletkező termékeket oszlopkromatográfiával különítettem el egymástól, illetve a kísérő szennyezésektől. Állófázisként Brockmann-II, neutrális alumínium-oxidot használtam, az eluens toluol : etil-acetát = 1:1-5 arányú oldószerelegy volt.
Egy Schlenk edénybe inert körülmények között bemértem 0,5 mmol 1'-jód-ferrocénkarboxamidot, vagy -glioxamidot, 0,025 mmol Pd(PPh3)4-t, 0,55 mmol vinil-tributil-sztannánt és oldószerként 7,5 ml toluolt használtam. A reakcióelegyet 100°C-os olajfürdőben mágneses keverő segítségével kevertem. A reakció előrehaladását gázkromatográfiás módszerrel követtem.
A reakció végeztével az elegyet kálium-fluorid vizes oldatával kiráztam és a szerves fázist elkülönítettem, majd Na2SO4-al szárítottam. A toluolt vákuumdesztillációval eltávolítottam, és a terméket metanolból átkristályosítottam.
Bemértem 0,5 mmol 1'-jód-N,N-dietil-ferrocénkarboxamidot, 0,025 mmol Pd(OAc)2-ot, 0,05 mmol PPh3-t, 0,75 mmol nátrium-tetrafenil-borátot egy szeptumos feltéttel, gázbevezetővel, gumiballonnal és golyós hűtővel ellátott háromnyakú lombikba és a rendszert szén-monoxid atmoszféra alá helyeztem. Majd a reakcióelegyhez hozzámértem 500 ml trietil-amint és 7,5 ml toluolt. Az elegyet 100°C-on 6 órán át kevertem.
A reakció befejeztével a reakcióelegyet mostam 5%-os H3PO4 oldattal, telített NaHCO3 oldattal, végül telített NaCl oldattal. A szerves fázist Na2SO4-al szárítottam, az oldószert vákuumban ledesztilláltam. A tiszta 1'-benzoil-N,N-dietil-ferrocénkarboxamidot oszlopkromatográfiával különítettem el a szennyezésektől. Állófázisként Brockmann-II, neutrális alumínium-oxidot használtam, eluensként 3:1 arányú benzol: etil-acetát oldószerelegyet alkalmaztam.
Egy saválló autoklávba inert körülmények között bemértem 0,5 mmol 1,1'-dijód-ferrocént, 0,05 mmol Pd(OAc)2-t, 0,1 mmol PPh3-t, a kétféle aminosav-metil-észter-hidrokloridból összesen 1 mmol-nyit, valamit 1 mmol cézium-karbonátot és 25 ml vízmentes toluolt. Ezután az autokláv reakcióterét a kívánt 40 bar szén-monoxid nyomás alá helyeztem és a megfelelő hőmérsékletű olajfürdőben mágneses keverő segítségével kevertem. A reakció előrehaladtát vékonyrétegkromatográfiás, illetve gázkromatográfiás módszerekkel követtem.
A reakció befejeztével a reakcióelegyet mostam 5%-os H3PO4 oldattal, telített NaHCO3 oldattal, végül telített NaCl oldattal. A szerves fázist Na2SO4-al szárítottam, az oldószert vákuumban ledesztilláltam. A keletkező termékeket oszlopkromatográfiával különítettem el egymástól, illetve a kísérő szennyezésektől. Állófázisként Brockmann-II, neutrális alumínium-oxidot használtam, az eluens összetétele toluol : etil-acetát = 1:1-5 arányú oldószerelegy volt.
Egy 100 cm3-es gömblombikba inert körülmények között bemértem 7,5 ml diklór-metánt, hozzáadtam 1 mmol N-ferrocenoil-glicin-metil-észtert és 1,5 mmol alumínium-kloridot. A reakcióelegyet -30°C-ra hűtöttem és ezen a hőfokon cseppenként hozzáadtam 1 mmol acetil-klorid 7,5 ml diklór-metánnal inert körülmények között készített oldatát. A reakcióelegyet -30°C-on 1 órán át kevertem, majd hagytam 0°C-ra melegedni és ezen a hőfokon további 30 percen keresztül kevertem.
A reakció végén a feleslegben maradt alumínium-kloridot víz hozzáadásával elbontottam, majd többszöri vizes mosással semlegesre mostam. A szerves fázist Na2SO4-al szárítottam, az oldószert lepároltam és tisztán megkaptam az 1'-acetil-N-ferrocenoil-glicin-metil-észter terméket.
A reakciók során a
ferrocénvázas kiindulási anyagok átalakulásának mértékét, valamint a reakciók
termékösszetételét gázkromatográfiás úton határoztam meg. A GC vizsgálatok
Hewlett-Packard típusú készüléken történtek eikozan belső standard
alkalmazásával, HP-5890 típusú,
A tiszta termékek szerkezetét 1H- és 13C-NMR segítségével azonosítottam. A spektrumok CDCl3 oldószerben,TMS belső standarddal, Bruker Avance 400 spektrométer alkalmazásával 400 és 100,58 MHz-en készültek.
Az infravörös spektrumokat KBr pasztillában AVATAR 330 FT-IR Thermo Nicolet készüléken vettem fel 400-4000 cm-1 tartományban. Az elemanalízisek mérése 1108 Carlo Erba típusú készüléken történt.
2a-c ismert vegyületek és analitikai adataik jól egyeznek az irodalmi értékekkel [89].
N-Ferrocenoil-glicin-metil-észter (2a)
H-NMR (400 MHz, CDCl3) d 6,11 (d, 5,5Hz, 1H, NH); 4,69 (t, 1,7Hz, 2H, 2,5-cp); 4,35 (t, 1,7Hz, 2H, 3,4-cp); 4,24 (s, 5H, nem szubsztituált cp); 4,15 (d, 5,5Hz, 2H, CH2); 3,79 (s, 3H OCH3). IR (cm-1): 3420, 3266; 1746; 1630; 1543.
Kitermelés:
N-Ferrocenoil-L-alanin-metil-észter (2b)
H-NMR (400 MHz, CDCl3) d: 6,40(d, 5,5 Hz, 1H, NH); 4,74 (qui, 5,5 Hz, 1H, CH); 4,72 (brs, 1H, 2-cp); 4,65 (brs, 1H, 5-cp); 4,33 (brs, 2H, 3,4-cp); 4,20 (s, 5H, nem szubsztituált cp); 3,77 (s, 3H, OCH3); 1,47(d, 5,5 Hz, 3H, CH3). IR (cm-1): 3430, 3245; 1730; 1635; 1540.
Kitermelés: 87 %
N-Ferrocenoil-L-fenilalanin-metil-észter (2c)
H-NMR (400 MHz, CDCl3) d 7,24 (m, 5H, Ph); 6,02 (brs, 1H, NH); 5,01 (m, 1H, CH); 4,61 (brs, 1H, 2-cp); 4,57 (brs, 1H, 5-cp); 4,31 (brs, 2H, 3,4-cp); 4,11 (s, 5H, nem szubsztituált cp); 3,75 (s, 3H, OCH3); 3,18 (m, 2H, CHaHb). 13C-NMR (100,5MHz, CDCl3): 172,4 (CO); 170,0(CO); 136,1; 129,2; 128,7; 127,3; 75,4; 70,5; 69,7; 68,3; 68,0; 52,8; 52,3; 38,1. IR (cm-1): 3420, 3240; 1728; 1634; 1540. MS (m/e): 391 (M+)/65; 229/45; 213/100; 185//57; 129/62; 121/55; 91/38; 56/25.
Kitermelés
N-Ferrocenoil-L-metionin-metilészter (2d)
H-NMR (400 MHz, CDCl3) d 6,45 (brs, 1H, NH); 4,85 (m, 1H, CH); 4,71 (brs, 1H, Cp-2); 4,65 (brs, 1H, Cp-5); 4,34 (brs, 2H, Cp-3,4); 4,21 (s, 5H, Cp); 3,77 (s, 3H, OCH3); 2,55 (t, 7Hz, S-CH2); 2,3-1,9 (m, 2H, CH2); 2,12 (s, 3H, S-CH3). IR (KBr, (cm-1)): 3268; 1744; 1625; 1533. MS (m/e): 375 (M+)/69; 213/100; 185/62; 129/37; 121/20; 56/25. Elemanalízis C H FeNO3S (375.27) számított: C, 54.41; H, 5.64; N, 3.73; mért: C, 54.22; H, 5.82; N, 3.61.
Kitermelés: 75%.
N-Ferrocenoil-L-prolin-metil-észter (2e)
H-NMR (400 MHz, CDCl3) d 4,85 (brs, 1H, Cp-2); 4,69 (brs, 1H, Cp-5); 4,61 (brs, 1H, CHCOO); 4,34 (brs, 2H, Cp-3,4); 4,25 (s, 5H, Cp); 3,94 (m, 1H, NCHa); 3,81 (m, 1H, NCHb); 3,76 (s, 3H, OCH3); 2,2 (m, 2H, CH2); 1,98 (m, 2H, CH2). 13C-NMR(100,5MHz, CDCl ):173,0; 169,6; 71,3; 70,5; 70,2; 69,7; 60,1; 52,1; 48,3; 28,7; 25,6. IR (KBr, (cm-1)): 1740; 1590. MS (m/e): 341 (M+)/79; 213/100; 185/45; 129/45; 121/47; 56/25. Elemanalízis C H FeNO3 (341.19) számított: C, 59.85; H, 5.61; N, 4.11; mért: C, 60.02; H, 5.50.; N, 4.23.
Kitermelés: 84 %.
N-Ferrocenil-glioxil-glicin-metil-észter (3a)
H-NMR (400 MHz, CDCl3) d 7,64 (brs, 1H, NH); 5,31 (s, 2H, Cp-2,5); 4,71 (s, 2H, Cp-3,4); 4,24 (s, 5H, Cp); 4,14 (d, 5.6Hz, 2H, CH2); 3,79 (s, 3H, OCH3). 13C-NMR(100,5MHz, CDCl ): 189,7; 169,5; 161,8; 74,5; 74,4; 74,3; 72,2; 70,6; 69,9; 52,5; 40,9 IR (KBr, (cm-1)): 3430; 1740; 1680; 1650; MS (m/e): 329 (M+)/79; 213/100; 185/82; 129/74; 121/47; 56/53. Elemanalízis C H FeNO4 (329.14) számított: C, 54.74; H, 4.59; N, 4.26; mért: C, 54.92; H, 4.71; N, 4.17.
Kitermelés: 89 %.
N-Ferrocenil-glioxil-L-alanin-metil-észter (3b)
H-NMR (400 MHz, CDCl3) d 7,61 (d, 8Hz, 1H, NH); 5,35 (brs; 1H, Cp-2); 5,25 (brs, 1H, Cp-5); 4,70 (brs, 2H, Cp-3,4); 4,63 (quint., 8 Hz , 1H, CH); 4,22 (s, 5H, Cp); 3,78 (s, 3H, OCH3); 1,51 (d, 8 Hz, 3H, -CH-CH3). 13C-NMR(100,5MHz, CDCl IR (KBr, (cm-1)): 3320, 1748; 1683; 1650. MS (m/e): 343 (M+)/66; 213/100; 185/49; 129/41; 121/22; 56/13. Elemanalízis C H FeNO4 (343.16) számított: C, 56.00; H, 4.99; N,4.08; mért: C, 56.17; H, 5.12; N, 4.17.
Kitermelés: 28 %.
N-Ferrocenil-glioxil-L-fenilalanin-metil-észter (3c)
H-NMR (400 MHz, CDCl3) d 7,24 (m, 5H, Ph); 6,50 (brs, 1H, NH); 5,25 (brs, 2H, Cp-2,5); 4,90 (m, 1H, CH); 4,68 (brs, 2H, Cp-3,4); 4,14 (s, 5H, Cp); 3,74 (s, 3H, OCH3); 3,18 (m, 2H, CHaHb). 13C-NMR(100,5MHz, CDCl ): 189,7; 171,2; 161,1; 135,7; 129,2; 128,8; 127,3; 74,4; 74,3; 72,2; 72,1; 70,5; 53,1; 52,5; 38,0. IR (KBr, (cm-1)): 3360; 1736; 1683; 1642. MS (m/e): 419 (M+)/35; 213/71; 185/62; 129/70; 121/45; 91/100; 56/26. Elemanalízis C H FeNO4 (419.26) számított: C, 63.03; H, 5.05; N, 3.34;mért: C, 62.,91; H, 5.14; N,3.22.
Kitermelés: 26 %.
N-Ferrocenil-glioxil-L-metionin-metil-észter (3d)
H-NMR (400 MHz, CDCl3) d 7,73 (d, 8 Hz,1H,NH); 5,34 (s, 1H, Cp-2); 5,26 (s, 1H, Cp-5); 4,76 (m, 1H, CH); 4,71 (brs, 2H, Cp-3,4); 4,22 (s, 5H, Cp); 3,78 (s, 3H, OCH3); 2,57 (t, 8 Hz, S-CH2); 2,29-2,0 (m, 2H, CH2); 2,11 (s, 3H, S-CH3). 13C-NMR(100,5MHz, CDCl ): 189,7; 171,5; 161,4; 74,6; 74,5; 74,4; 72,5; 71,9; 70,6; 52,7; 51,4; 31,5; 30,1; 15,5. IR (KBr, (cm-1)): 3360; 1740; 1683; 1642. MS (m/e): 403 (M+)/85; 213/100; 185/53; 129/48; 121/24; 56/13. Elemanalízis C H FeNO3S (403.28) számított: C, 53.61; H, 5.25; N, 3.47; mért: C, 53.84; H, 5.11; N, 3.59.
Kitermelés: 37 %.
N-Ferrocenil-glioxil-L-prolin-metil-észter (3e)
H-NMR (400 MHz, CDCl3) d 5,01 (brs, 2H, Cp-2,5); 4,73 (brs, 1H, CHCOO); 4,62 (brs, 2H, Cp-3,4); 4,3 (s, 5H, Cp); 3,8 (s, 3H, OCH3); 3,65 (m, 2H, N-CH2); 1,9-2,3 (m, 4H, CH2-CH2). 13C-NMR(100,5MHz, CDCl ): 189,2; 172,1; 164,5; 74,9 ; 73,8; 73,7; 70,6; 70,5; 70,4; 58,5; 52,4; 47,6; 29,0; 25,0. IR (KBr, (cm-1)): 1744; 1665; 1634. MS (m/e): 369 (M+)/43; 213/100; 185/49; 129/39; 121/26; 56/22. Elemanalízis C H FeNO4(369.20) számított: C, 58.56; H, 5.19; N, 3.79; mért: C, 58.41; H, 5.23; N, 3.87.
Kitermelés: 30 %.
1-Ferrocenoil-1,8-diaza-cikloundekan-2-on (6a)
H-NMR (400 MHz, CDCl3) d 7,38 (brs, 1H, NH); 4,80 (brs; 2H, Cp-2,5); 4,29 (brs, 2H, Cp-3,4); 4,19 (s, 5H, Cp); 3,54 (m, 2H, C(O)NCH2); 3,34 (m, 4H, CH2NCH2); 2,59 (m, 2H, C(O)CH2); 1,72 (m, 8H, 4CH2). C-NMR(100,5MHz, CDCl ): 177,3; 170,2; 70,3; 70,2; 69,7; 68,3; 49,5; 44,7; 37,2; 34,7; 30,0; 28,4; 27,3; 23,5. IR (KBr, (cm-1)): 1650; 1638. MS: 382 (M+). Elemanalízis C H FeN2O2 (382.29) számított: C, 62.84; H, 6.86; N, 7.33; mért: C, 62.97; H, 6.71; N, 7.41.
1-Ferrocenil-glioxil-1,8-diaza-cikloundekan-2-on (6b)
H-NMR (400 MHz, CDCl3) d 8.00 (brs, 1H, NH); 5.29 (brs; 2H, Cp-2,5); 4.65 (brs, 2H, Cp-3,4); 4.20 (s, 5H, Cp); 3.47 (m, 2H, C(O)NCH2); 3.34 (m, 4H, CH2NCH2); 2.55 (m, 2H, C(O)CH2); 1.68 (m, 8H, 4CH2). 13C-NMR(100,5MHz, CDCl IR (KBr, (cm-1)):. 1700; 1646; 1634. MS: 410 (M+). Elemanalízis C H FeN2O3 (410.30) számított: C, 61.48; H, 6.39; N, 6.83; mért: C,61.32 ; H, 6.51; N, 6.75.
1'-Jód-N,N-dietil-ferrocénkarboxamid (8a)
H-NMR(400 MHz, CDCl d: 4,58 (brs, 2H, Cp-2,5); 4.45 (brs, 2H, Cp-
Kitermelés: 35 %.
1'-Jód-N,N-dibutil-ferrocénkarboxamid (8b)
H-NMR(400 MHz, CDCl d: 4,53 (t, 1,8 Hz, 2H, Cp); 4,41 (t, 1,8 Hz, 2H, Cp); 4,26 (t, 1,8 Hz, 2H, Cp); 4,22 (t, 1,8 Hz, 2H, Cp); 3,37 (t, 7,9Hz, 4H, NCH2); 1,57 (q, 4H, 7,9Hz, NCH2CH2); 1,31 (m, 4H, N(CH2)2CH2); 0,92 (t, 6H, 7,9Hz, N(CH2)3CH3). IR (KBr, (cm-1)): 1610. MS (m/e): 467(M+)/100; 339/92; 311/85; 247/62; 213/123;183/169. Elemanalízis C H FeINO (467,17): C, 48,85; H, 5,61; N, 3,00; számított: C, 48,97, H, 5,47 ; N, 3,12.
Kitermelés: 31 %.
1'-Jód-morfolino-ferrocénkarboxamid (8c)
H-NMR(400 MHz, CDCl ) d: 4,51 (t, 1,6 Hz, 2H, Cp); 4,43 (t, 1,6 Hz, 2H, Cp); 4,35 (t, 1,6 Hz, 2H, Cp);4,25 (t, 1,6 Hz, 2H, Cp); 3,68 (m, 8H, NCH2CH2O). 13C-NMR(100,5MHz, CDCl ) d: 168,8; 80,3; 76,6; 73,1; 72,6; 71,2; 66,9; 40,1. IR (KBr, (cm-1)): 1618. MS(m/e): 425 (M+)/100; 339/15; 311/8; 213/13; 183/13; 56/10. Elemanalízis C H FeINO2 (425,05): C, 42,39; H, 3,79; N, 3,30; számított: C, 42,60, H, 3,87 ; N, 3,19.
Kitermelés: 14 %.
1'-Jód-piperidino-ferrocénkarboxamid (8d)
H-NMR(400 MHz, CDCl ) d: 4,5 (t, 1,6 Hz, 2H, Cp); 4,43 (t, 1,6 Hz, 2H, Cp); 4,26 (t, 1,6 Hz, 2H, Cp);4,25 (t, 1,6 Hz, 2H, Cp); 3,59 (m, 4H, NCH2); 1,57 (m, 6H, NCH2(CH2)3). 13C-NMR(100,5MHz, CDCl ) d: 168,3; 81,5; 76,4; 73,0; 72,4; 71,2; 46,2; 43,1; 40,1; 29,7; 26,1; 24,8. IR (KBr, (cm-1)): 1616. MS (m/e): 423(M+)/100; 339/11; 311/11, 296/35; 247/11; 213/45; 183/35; 56/15. Elemanalízis C H FeINO (423,08): C, 45,42; H, 4,29; N, 3,31; számított: C, 45,27, H, 4,12 ; N, 3,45.
Kitermelés: 19 %.
1'-Jód-N,N-dietil-ferrocénglioxamid (9a)
H-NMR(400 MHz, CDCl ) d: 4,82 (brs, 2H, Cp); 4,58 (brs, 2H, Cp); 4,53 (brs, 2H, Cp); 4,38 (brs, 2H, Cp); 3,46 (q, 6,8 Hz, 2H, NCH2CH3); 3,25 (q, 6,8 Hz, 2H, NCH2CH3); 1,23 (t, 6,8 Hz, 3H, NCH2CH3); 1,14 (t, 6,8 Hz, 3H, NCH2CH3). 13C-NMR(100,5MHz, CDCl ) d: 197,7; 166,3; 77,5; 76,4; 76,1; 72,4; 72,3; 42,3; 39,9; 39,0; 14,2; 12,8. IR (KBr, (cm-1)): 1642, 1661. MS(m/e): 439 (M+)/100; 339/83; 311/39; 275/15; 183/27; 128/18; 100/43; 72/68; 56/32. Elemanalízis C H FeINO2 (439,08): C, 43,77; H, 4,13; N, 3,19; számított: C, 43,52, H, 4,01; N, 3,31.
Kitermelés: 11 %.
1'-Jód-N,N-dietil-ferrocénglioxamid (9b)
MS(m/e): 495 (M+)/100; 368/13; 340/17; 276/14; 241/30; 213/17; 207/17; 185/11; 152/9; 128/37; 121/33.
1'-Jód-morfolino-ferrocénglioxamid (9c)
H-NMR(400 MHz, CDCl ) d: 4,85 (t, 1,5 Hz, 2H, Cp); 4,60 (t, 1,5 Hz, 2H, Cp); 4,52 (t, 1,5 Hz, 2H, Cp); 4,35 (t, 1,5 Hz, 2H, Cp); 3,69 (m, 6H, morpholine); 3,45 (m, 2H,). 13C-NMR(100,5MHz, CDCl ) d: 196,4; 165,0; 76,7; 76,1; 72,6; 72,1; 70,7; 66,8; 66,7; 46,5; 41,7; 39,8. IR (KBr, (cm-1)): 1646; 1667. MS(m/e): 453 (M+)/91; 339/100; 311/40; 183/21; 128/15; 56/12. Analysis calculated for C H FeINO3 (453,06): C, 42,42; H, 3,56; N, 3,09; Found: C, 42,55, H, 3,67 ; N, 3,21.
Kitermelés: 40 %.
1'-Jód-piperidino-ferrocénglioxamid (9d)
H-NMR(400 MHz, CDCl ) d: 4,82 (brs, 2H, Cp); 4,55 (brs, 2H, Cp); 4,50 (brs, 2H, Cp); 4,35 (brs, 2H, Cp); 3,59 (m, 2H, NCH2); 3,30 (m, 2H, NCH2); 1,62 (m, 4H, NCH2CH2); 1,54 (m, 2H, N(CH2)2CH2). IR (KBr, (cm-1)): 1644; 1662. MS(m/e): 451(M+)/22; 339/62; 311/32; 183/48; 128/54; 121/39; 56/100. Elemanalízis C H FeINO2 (451,09): C, 45,27; H, 4,02; N, 3,11; számított: C, 45,45; H, 4,15; N, 3,21.
Kitermelés: 38 %.
1,1'-N,N-dietil-ferrocéndikarboxamid (10a)
Spektroszkópiai adatai megfelelnek az irodalmi értékeknek. [89]
H-NMR(400 MHz, CDCl ) d 4,63 (s, 4H, 2,5,2',5'-fc); 4,36 (s, 4H 3,4,3',4'-fc); 3,50 (m, 8H, N-CH2-CH3); 1,82 (m, 12H, N-CH2-CH3); 13C-NMR (100,5MHz, CDCl3): d 168,96 CO; 80,63; 71,69; 71,35; 42,66; 40,71; 14,57; 12,84; MS (m/e): 384 (M+)/100; 312/5; 285/11; 241/18; 220/11; 213/11; 121/33.
Kitermelés
1,1'-N,N-dibutil-ferrocéndikarboxamid (10b)
H-NMR(400 MHz, CDCl ) d: 4,59 (t, 1,9 Hz, 4H, Cp); 4,34 (t, 1,9 Hz, 4H, Cp); 3,35 (t, 7,8Hz, 8H, NCH2); 1,58 (m, 8H, NCH2CH2); 1,15 (m, 8H, N(CH2)2CH2); 0,89 (m, 12H, N(CH2)3CH3). IR (KBr, (cm-1)): 1618. MS(m/e): 496 (M+)/100; 368/12; 340/17; 241/32; 128/35; 121/32; 57/38; 56/12.
Kitermelés: 68 %.
1,1'-Morfolino-ferrocéndikarboxamid (10c)
Spektroszkópiai adatai megfelelnek az irodalmi értékeknek. [90]
H-NMR(400MHz, CDCl3) d: 4,57 (brs, 4H); 4,37 (brs, 4H); 3,66 (m, 12H); 3,33 (m, 4H). IR (KBr, (cm-1)): 1616. MS (m/e): 412 (M+)/100; 327/12; 299/20; 241/57; 234/32; 213/21; 207/21; 185/18; 149/19; 129/21; 121/95.
Kitermelés: 72%
1,1'-Piperidino-ferrocéndikarboxamid (10d)
Spektroszkópiai adatai megfelelnek az irodalmi értékeknek. [90]
H-NMR(400MHz, CDCl3) d: 4,59 (brs, 4H); 4,36 (brs, 4H); 3,58 (m, 8H); 1,58 (m, 12H). IR (KBr, (cm-1)): 1618. MS (m/e): 408 (M+)/52; 325/12; 297/24; 241/16; 213/12; 204/24; 186/21; 140/18; 121/46; 84/100.
Kitermelés: 75%.
1,1'-N-butil-ferrocéndikarboxamid (10e)
H NMR(400MHz, CDCl3) d: 6,67 (brs, 2H, NH); 4,46 (s, 4H); 4,3 (s, 4H); 3,36 (q, 6,8 Hz, 4H); 1,61 (m, 4H); 1,41 (m, 4H); 0,98 (t, 7,2 Hz, 6H). IR (KBr, (cm-1)): 3321; 1630 ; 1552. MS (m/e): 384(M+)/52; 312/14; 285/15; 241/28; 190/28; 146/28; 121/100.
Kitermelés: 68%.
1'-(N',N'-dietil-karbamoil)-N,N-dibutil-ferrocénkarboxamid (10ab)
H-NMR(400MHz, CDCl ) d: 4,62 (brs, 2H, Cp); 4,58 (brs, 2H, Cp); 4,35 (brs, 2H, Cp); 4,27 (brs, 2H Cp); 3,44 (q, 6,4 Hz, 4H, NCH2CH3); 3,35 (t, 8Hz, 4H, NCH2CH2); 1,54 (m, 4H, NCH2CH2); 1,26 (m, 4H, N(CH2)2CH2); 1,17 (t, 6,4 Hz, 6H, NCH2CH3); 0,91 (t, 8Hz, 6H, N(CH2)3CH3). 13C-NMR(100,5MHz, CDCl ) d: 169,2; 169,0; 81,1; 80,6; 71,7; 71,6; 71,5; 71,3; 48,5; 46,4; 42,5; 40,9; 31,4; 29,6; 20,2; 20,1; 13,8. IR (KBr, (cm-1)): 1614. MS(m/e): 440 (M+)/100; 241/37; 220/43; 128/65; 121/80; 70/63; 57/35, 56/32. Elemanalízis C H FeN2O2 (440,41): C, 65,45; H, 8,24; N, 6,36; számított: C, 65,63, H, 8,31 ; N, 6,28.
Kitermelés: 77 %.
1'-(Morfolino-karbamoil)-N,N-dietil-ferrocénkarboxamid (10ac)
H-NMR (400MHz, CDCl3) d: 4,62 (s, 2H, 2,5-Cp); 4,58 (s, 2H,
Kitermelés: 85%.
1'-(Piperidino-karbamoil)-N,N-dietil-ferrocénkarboxamid (10ad)
H-NMR (400MHz, CDCl3) d: 4,63 (s, 2H, 2,5-Cp); 4,57 (s, 2H,
Kitermelés:58%.
1'-(N'-butil-karbamoil)-N,N-dietil-ferrocénkarboxamid (10ae)
H NMR(400MHz, CDCl3) d: 8,42 (brs, 1H); 4,60 (s, 2H); 4,36 (brs, 4H); 4,32 (s, 2H); 3,47 (m, 2H); 3,38 (m, 4H); 1,29-1,65 (m, 4H); 1,19 (m, 6H); 0,95 (t, 7,5Hz, 3H). IR (KBr, (cm-1)): 3315; 1646, 1613; 1535. MS (m/e): 384 (M+)/38; 313/8; 285/17; 241/26; 229/12; 220/22; 213/22; 190/20; 163/20; 149/18; 128/38; 121/86; 72/100; 56/68. Elemanalízis C20H28FeN2O2 (384,30): C, 62,51; H, 7,34; N, 7,29; számított: C, 62,15; H, 7,61; N, 7,62.
Kitermelés: 44%.
1'-(N'-butil-karbamoil)-N,N-dibutil-ferrocénkarboxamid (10be)
H NMR(400MHz, CDCl3) d: 8,53 (brs, 1H); 4,59 (s, 2H); 4,28 (brs, 6H); 3,10-3,42 (m, 6H); 1,10-1,65 (m, 12H); 0,88-1,00 (m, 9H). IR (KBr, (cm-1)): 3297; 1650; 1610; 1535. MS (m/e): 440(M+)/100; 312/18; 241/44; 128/56; 121/63; 56/19. Elemanalízis C24H36FeN2O2 (440,41): C, 65,45; H, 8,24; N, 6,36; számított: C, 65,81; H, 8,56; N, 6,12.
Kitermelés: 36%.
1'-(Piperidino-karbamoil)-morfolino-ferrocénkarboxamid (10cd)
H NMR(400MHz, CDCl ) d: 4,59 (s, 2H, Cp); 4,56 (s, 2H, Cp); 4,39 (s, 2H); 4,36 (s, 2H Cp); 3,67 (m, 8H); 3,56 (m, 4H); 1,55 (m, 6H). IR (KBr, (cm-1)): 1615. MS (m/e): 410(M+)/100; 297/19; 241/46; 207/52; 186/35; 128/28.
Kitermelés: 51%.
1'-(Morfolino-karbamoil)-N-butil-ferrocénkarboxamid (10ce)
H NMR(400MHz, CDCl3) d: 8,32 (brs, 1H); 4,57 (s, 2H); 4,33 (brs, 4H); 4,31 (s, 2H); 3,64 (m, 8H); 3,36 (q, 7.5Hz, 2H); 1,60 (qui, 7,5Hz, 2H); 1,42 (m, 2H); 0,95 (t, 7,5Hz, 3H). IR (KBr, cm-1): 3252; 1642; 1593; 1552. MS (m/e): 398 (M+)/34; 313/8; 285/14; 241/34; 213/14; 185/13; 149/20; 121/100; 56/71. Elemanalízis C20H26FeN2O3 (398,28): C, 60,31; H, 6,58; N, 7,03; számított: C, 60,78; H, 6,79; N, 6,75.
Kitermelés: 62%.
1'-(N',N'-dietil-karbamoil)-N,N-dietil-ferrocénglioxamid (11a)
MS (m/e): 412 (M+)/100; 312/30; 284/6; 241/74; 207/56; 162/9; 121/33.
1'-vinil-N,N-dietil-ferrocénkarboxamid (13a)
H-NMR(400MHz, CDCl d: 6,42 (dd, 10,8 Hz, 17,6Hz, 1H, CH=CH2); 5,35 (dd, 1,2 Hz, 17,6 Hz, 1H, CH=CHAHB); 5,05 (dd, 1,2 Hz, 10,8 Hz, 1H, CH=CHAHB); 4,53 (t, 2 Hz, 2H, Cp); 4,37 (t, 2 Hz, 2H, Cp); 4,26 (t, 2 Hz, 2H, Cp); 4,22 (t, 2 Hz, 2H, Cp); 3,49 (q, 6,8 Hz, 4H, NCH2CH3); 1,20 (t, 6,8Hz, 6H, NCH2CH3). C-NMR(100,5MHz, CDCl d: 169,2; 133,8; 112,1; 84,7; 79,5; 71,4; 70,7; 70,6; 68,4; 42,6; 40,4; 14,3; 12,8. IR (KBr, (cm-1)): 1608. MS(m/e): 311 (M+)/100; 239/56; 212/51; 210/50; 121/55; 56/34. Elemanalízis C H FeNO (311,21): C, 65,61; H, 6,80; N, 4,50; számított: C, 65,78, H, 6,71 ; N, 4,57.
Kitermelés: 69 %.
1'-Vinil-morfolino-ferrocénglioxamid (14c)
H-NMR(400MHz, CDCl d: 6,34 (dd, 10,8 Hz, 17,6Hz, 1H, CH=CH2); 5,36 (dd, 1,2 Hz, 17,6 Hz, 1H, CH=CHAHB); 5,11 (dd, 1,2 Hz, 10,8 Hz, 1H, CH=CHAHB); 4,76 (brs, 2H, Cp); 4,55 (brs, 2H, Cp); 4,46 (brs, 2H, Cp); 4,38 (brs, 2H, Cp); 3,74 (m, 2H,); 3,69 (m, 2H,); 3,64 (m, 2H,); 3,42 (m, 2H,). C-NMR(100,5MHz, CDCl d: 196,9; 165,2; 132,6; 113,4; 86,0; 75,5; 75,2; 71,6; 71,2; 68,9; 66,8; 66,7; 46,4; 41,7. IR (KBr, (cm-1)): 1630; 1652. MS(m/e): 353 (M+)/36; 239/100; 211/82; 121/57; 56/55. Elemanalízis C H FeNO3 (353,20): C, 61,21; H, 5,42; N, 3,97; számított: C, 61,37, H, 5,31 ; N, 3,85.
Kitermelés: 85 %.
1'-Vinil-piperidino-ferrocénglioxamid (14d)
H-NMR(400MHz, CDCl d: 6,36 (dd, 10,4 Hz, 17,6Hz, 1H, CH=CH2); 5,36 (dd, 1,2 Hz, 17,6 Hz, 1H, CH=CHAHB); 5,11 (dd, 1,2 Hz, 10,4 Hz, 1H, CH=CHAHB); 4,74 (t, 2 Hz, 2H, Cp); 4,52 (t, 2 Hz, 2H, Cp); 4,47 (t, 2 Hz, 2H, Cp); 4,39 (t, 2 Hz, 2H, Cp); 3,6 (m, 2H, NCH2); 3,31 (m, 2H, NCH2); 1,62 (m, 4H, NCH2CH2); 1,55 (m, 2H, N(CH2)2CH2). C-NMR(100,5MHz, CDCl d: 198,0; 165,3; 132,8; 113,2; 85,9; 75,7; 74,9; 71,7; 71,1; 68,9; 47,1; 42,2; 26,2; 25,5; 24,5. IR (KBr, (cm-1)): 1630 ; 1650. MS(m/e): 351 (M+)/56; 239/100; 211/52; 121/32; 56/27. Elemanalízis C H FeNO2 (351,23): C, 64,97; H, 6,03; N, 3,99; számított: C, 65,11, H, 6,11 ; N, 4,10.
Kitermelés: 82 %.
1'-benzoil-N,N-dietil-ferrocénkarboxamid (15a)
H-NMR(400MHz, CDCl d: 7,88 (d, 6Hz, 2H, Ph); 7,52 (t, 6Hz, 1H, Ph); 7,44 (t, 6Hz, 2H, Ph); 4,93 (brs, 2H, Cp); 4,65 (brs, 2H, Cp); 4,59 (brs, 2H, Cp); 4,29 (brs, 2H, Cp); 3,37 (q, 7,2 Hz, 4H, NCH2CH3); 1,12 (t, 7,2 Hz, 6H, NCH2CH3). C-NMR(100,5MHz, CDCl d: 198,6; 168,2; 139,5; 131,7; 128,2; 127,5; 81,6; 79,1; 74,9; 73,0; 71,8; 71,5; 42,5; 40,7; 14,3; 12,8. IR (KBr, (cm-1)):1610; 1632. MS(m/e.): 389 (M+)/100; 317/30; 290/27; 260/31; 133/38; 72/28; 56/62. Elemanalízis C H FeNO2 (389,28): C, 67,88; H, 5,96; N, 3,60; számított: C, 67,95, H, 5,85 ; N, 3,72.
Kitermelés: 78 %.
N,N-Dietil-ferrocénkarboxamid (16a)
A korábban már karakterizált vegyülettel [91] való azonosságát GC-MS méréssel igazoltam.
MS (m/e): 285(M+)/100; 213/44; 186/44; 185/31; 121/40; 129/35; 56/32.
Morfolino-ferrocénkarboxamid (16c)
A korábban már karakterizált vegyülettel [90] való azonosságát GC-MS méréssel igazoltam.
MS (m/e): 299(M+)/60; 213/38; 185/38; 129/50; 56/100.
17a-c [28] 17d [92] és 17bc [28] ismert vegyületek és analitikai adataik (1H NMR és/vagy MS) jól egyeznek az irodalmi értékekkel.
Fe[C5H4-CO-Gly-OMe]2 (17a)
H NMR (400MHz CDCl3) 7,97 (brs, 2H, NH); 4,84 (brs, 4H, Cp,); 4,51 (brs, 4H, Cp); 4,32 (brs, 4H, CH2); 3,84 (s, 6H, OCH3).
Fe[C5H4-CO-Ala-OMe]2 (17b)
H NMR (400 MHz, CDCl3) 7,73 (d, 1H, NH); 4,89 (brs, 2H, Cp,); 4,84 (m, 2H, CH); 4,74 (brs, 2H, Cp); 4,54 (brs, 2H, Cp); 4,33 (brs, 2H, Cp); 3,80 (s, 6H, OCH3); 1,38 (d, 7,5 Hz, 6H, CH-CH3). MS (m/e): 444 (M+)/100; 412/2; 384/5; 342/9; 271/14; 250/3; 223/3; 190/3; 160/7; 130/16.
Fe[C5H4-CO-Phe-OMe]2 (17c)
MS (m/e): 596 (M+)/100; 434/8; 271/26; 91/10.
Fe[C5H4-CO-Met-OMe]2 (17d)
MS (m/e): 564 (M+)/100; 490/7; 458/3; 433/7; 402/11; 355/13; 310/16; 271/42; 218/34; 190/53; 160/37.
Fe[C5H4-CO-Phe-OMe][C5H4-CO-Gly-OMe] (17ac)
H NMR
(400 MHz, CDCl3) d: 7,87
(brs, 1H, NH); 7,54 (d, 8Hz, 1H, NH); 7,14-7,27 (m, 5H, Ph); 4,95 (m, 1H, CH);
4,85 (brs, 2H, Cp); 4,56 (brs, 2H, Cp); 4,53 (m, 1H, CHa,b-CO2Me); 4,52 (brs, 1H, Cp); 4,50
(brs, 1H, Cp); 4,32 (brs, 2H, Cp); 3,83 (s, 3H, OCH3); 3,79 (s, 3H,
OCH3); 3,69 (dd, 7,6 Hz, 18Hz, 1H, CHa,b-CO2Me);
3,12 (dd, 14 Hz, 4,9Hz, 1H, CHa,b-Ph);
2,84 (dd, 14 Hz, 10,3 Hz, 1H, CHa,b-Ph).
Kitermelés: 47%.
Fe[C5H4-CO-Gly-OMe][C5H4-CO-Met-OMe] (17ad)
H NMR
(400 MHz, CDCl3) d: 7,95
(brs, 1H, NH); 7,72 (brs, 1H, NH); 4,95 (brs, 2H, Cp); 4,88 (brs, 2H, Cp); 4,76
(brs, 2H, Cp); 4,64 (m, 1H, CH); 4,39 (brs, 2H, Cp); 3,85 (s, 3H, OCH3);
3,84 (s, 3H, OCH3); 3,78 (m, 2H, CH2-CO2Me); 2,55 (m, 2H, CH2-S); 2,18
(m, 2H, CH2-CH2S);
2,05 (s, 3H, S-CH3).
Kitermelés: 39%.
Fe[C5H4-CO-Phe-OMe][C5H4-CO-Ala-OMe] (17bc)
H NMR (400 MHz, CDCl3) d: 7,84 (brs, 1H, NH); 7,74 (brs, 1H, NH); 7,30-7,20 (m, 5H, Ph); 5,02 (m, 1H, CH); 4,82-4,94 (m, 3H, Cp+CH); 4,76 (brs, 1H, Cp); 4,71 (brs, 1H, Cp); 4,54 (brs, 2H, Cp); 4,35 (brs, 2H, Cp); 3,87 (s, 3H, OCH3); 3,84 (s, 3H, OCH3); 3,15 (m, 1H, CHa,b-Ph); 2,91 (m, 1H, CHa,b-Ph); 1,42 (d, 7,5 Hz, 6H, CH-CH3). Elemanalízis C26H28N2O6Fe: C, 60,01; H, 5,42; N, 5,38; számított: C, 60,31; H, 5,21; N, 5,49.
Kitermelés: 27%.
Fe[C5H4-CO-Ala-OMe][C5H4-CO-Met-OMe] (17bd)
H NMR
(400 MHz, CDCl3) d: 7,78
(d, 1H, NH); 7,72 (d, 1H, NH); 4,88 (m, 4H, Cp, 2CH); 4,73 (brs, 2H, Cp); 4,54
(brs, 2H, Cp); 4,34 (brs, 2H, Cp); 3,81 (s, 6H, OCH3); 2,66 (m, 1H,
CHa,b-S); 2,54
(m, 1H, CHa,b-S); 2,08 (s, 3H, S-CH3);
2,06 (m, 2H, CH2-CH2S);
1,39 (d, 3H, CH-CH3).
Kitermelés: 40%.
Fe[C5H4-CO-Phe-OMe][C5H4-CO-Met-OMe] (17cd)
H NMR (400 MHz, CDCl3) d: 7,69 (d, 1H, NH); 7,48 (s, 1H, NH); 5,03 (m, 1H, CH-CH2Ph,); 4,90 (m, 2H, Cp); 4,74 (m, 3H, Cp+CH-CH2S); 4,51 (m, 2H, Cp); 4,31 (m, 2H, Cp); 3,81 (s, 6H, OCH3); 3,20 (m, 1H, CHa,b-Ph); 2,90 (m, 1H, CHa,b-Ph); 2,71 (m, 1H, CHa,b-S); 2,55 (m, 1H, CHa,b-S); 2,08 (s, 3H, S-CH3); 2,06 (m, 2H, CH2-CH2S). 13C NMR (100,5 MHz, CDCl3) d: 175,7 (COészter); 170,6 (COamid); 75,9; 72,2; 71,6; 70,5; 70,4; 54,0; 53,1; 51,6; 37,2; 30,9; 15,7. IR (KBr (cm-1)): 3303
Kitermelés: 52%.
1'-Acetil-N-ferrocenoil-glicin-metil-észter (18)
H NMR (400 MHz, CDCl3) d: 6,54 (brs, 1H, NH); 4,88 (s, 2H); 4,65 (s, 2H); 4,55 (s, 2H); 4,40 (s, 2H); 4,16 (s, 2H); 3,78 (s, 3H); 2,38 (s, 3H).
Kitermelés: 99%.
A ferrocén felfedezését követően számos kutatócsoport irányította figyelmét az addig ismeretlen molekula szerkezetének megismerésére, funkcionalizálására, ami új lendületet adott a fémorganikus kémia fejlődésének. Hamarosan különböző szintézisutak segítségével a legkülönbözőbb ferrocénszármazékok megjelenése színesítette a fémorganikus származékok palettáját. A ferrocénszármazékok kedvező tulajdonságaiknak köszönhetően gyakorlati szempontból mind nagyobb jelentőségre tesznek szert, ami a szintézisük minél gazdaságosabb, hatékonyabb megvalósítását teszik szükségessé. Munkám során N-ferrocenoil-aminosav-észtereket, a ferrocénvázas vegyületek között újszerű ferrocénglioxamidokat és egyéb ferrocénszármazékokat kívántam szintetizálni a ferrocénszármazékok előállítására eddigiekben nem alkalmazott palládium katalizált homogénkatalitikus karbonilezési eljárással.
A Pannon Egyetem Szerves Kémia Intézeti Tanszékén elkezdett jód-ferrocén karbonilezési kísérletek során új típusú ferrocénglioxamidokat szintetizáltak, ferrocénkarboxamid melléktermék keletkezése mellett.
A munka folytatásaként vizsgáltam a jód-ferrocén palládium katalizált aminokarbonilezését aminosav-észterek mint nukleofil reakciópartnerek jelenlétében. Célom a mono- és dikarbonilezett vegyületek minél szelektívebb előállítása volt.
Megállapítottam, hogy a reakciók szelektivitását a korábbiakkal ellentétben nem a hőmérséklettel, hanem a megfelelő bázis alkalmazásával lehet eredményesen befolyásolni. Vizsgálataim eredményeként meghatároztam a ferrocénglioxamidok, illetve ferrocénkarboxamidok előállításához szükséges optimális reakciókörülményeket. Kimutattam, hogy karbonilezséi körülmények között a bázisként alkalmazott DBU is acilezhető.
Az e reakciókban szerzett tapasztalatokat is felhasználva vizsgáltam az 1,1'-dijód-ferrocén aminokarbonilezési reakcióját. A reakciókörülmények megfelelő megválasztásával 1'-jód-ferrocénkarboxamidokat, illetve -glioxamidokat szintetizáltam, melyeknek további homogénkatalitikus reakcióit is megvalósítottam.
Új, egyszerű és hatékony eljárást dolgoztam ki két különböző amidocsoportot tartalmazó 1,1'-ferrocéndikarboxamidok előállítására, melyekre rendkívül kevés példát találunk az irodalomban.
Ezzel analóg módon nem szimmetrikusan diszubsztituált 1,n'-ferrocenoil-aminosav-észtereket szintetizáltam.
HO-Su: N-Hidroxi-szukcinimid
HO-Bt: 1-Hidroxi-benzotriazol
DCC N,N'-Diciklohexil-karbodiimid
EDC 1-Etil-3-(3-(dimetil-amino)-propil)-karbodiimid-hidroklorid
HBTU: O-Benzotriazol-N,N,N',N'-tetrametil-uronium-hexafluoro-foszfát
TBTU: O-(Benzotriazol-1-il)-N,N,N',N'-tetrametiluronium-tetrafluoroborát
DMAP: 4-(Dimetil-amino)-piridin
CMPI: 2-Klór-1-metil-piridínium-jodid
TFA Trifluor-ecetsav
BOC: Terc-butoxi-karbonil csoport
Kealy, T. J.; Pauson, P. L.; (1951). Nature 168, 1039
Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. J. Am. Chem. Soc 1952, 74, 2125
Fischer, E. O.; Pfab, W. Z. Naturforsch. B 1952, 7, 377
Faigl, F.; Kollár, L.; Kotschy A.; Szepes, L. Szerves fémvegyületek kémiája Nemzeti Tankönyvkiadó 2001, 290
Beer P. D.; Keefe, A. D.; Sikanyika, H. J Chem Soc
Moutet, J.-C.; Saint.Aman, E.; Ungureanu, M.; Visan, T. J. Electroanal. Chem.
Heinze, K.; Schlenker, M. Eur. J. Inorg. Chem. 2005, 66
Alonso, E.; Laband, A.; Raehm, L.; Kern, J.-M.; Astruc, D. C. R. Comptes Rendus de l'Académie des Sciences - Series IIC - Chemistry 1999, 2, 209
Westwood, J.; Coles, S.J.; Collinson, S.R.; Gasser, G.; Green, S.J.; Hursthouse, M.B.; Light, M.E.; Tucker, J.H.R. Organometallics 2004, 23, 946
Collinson, S. R.; Gelbrich, T.; Hursthouse, M. B.; Tucker, J. H. R. Chem. Commun 2001. 555
Ihara, T.;Maruo, Y.; Takenaka, S.;Takagi, M. Nucleic Acids Res. 1996, 24, 4273
Degani, Y.; Heller, A. J. Am. Chem. Soc. 1988, 110, 2615
Weliky, N.; Gould, E. S. J. Am. Chem. Soc. 1957, 79, 2742.
Rausch, M.; Shaw, P.; Mayo, D.; Lovelace, A. M. J. Org. Chem. 1958, 23, 505.
Pberhoff, M.; Duda, L.; Karl, J.; Mohr, R.; Erker, g.; Fröhlich, R.; Grehl, M. Organometallics 1996, 15, 4005
Acton, E. M.; Silverstein, R. M. J. Org. Chem. 1957, 24, 1487.
Galow, T. H.; Rodrigo, J.; Cleary, K.; Cooke, G.; Rotello, V. M. J. Org. Chem. 1999, 64, 3715.
Schetter, B.; Speiser, B. J. Organomet. Chem. 2004, 689, 1472
Seio, K.; Mizuta, M.; Terada, T.; Sekine, M. Tetrahedron Lett. 2004, 45, 6783
Mandal, H. S.; Kraatz, H.-B. J. Organomet. Chem. 2003, 674, 32.
Schlögl, K Monatsh. Chem. 1957, 88, 601.
Herrick, R. S.; Jarret, R. M.; Curran, T. P.; Dragoli, D. R.; Flaherty, M.B.; Lindyberg, S. E.; Slate, R. A.; Thornton, L. C. Tetrahedron Lett. 1996, 37, 5289.
Kraatz, H.-B.; Lusztyk, J.; Enright, G. D. Inorg. Chem. 1997, 36, 2400.
Staveren, van D. R.; Weyhermüller, T.; Metzler-Nolte, N. J. Cem. Soc. Dalton Trans. 2003, 210
Bauer, W.; Polborn, K.; Beck, W. J. Organomet. Chem. 1999, 579, 269.
Kitagawa, K.; Morita, T.; Kawasaki, M.; Kimura, S. J. Polymer. Sci. A 2003, 41, 3493.
Xu, Y.; Kraatz, H.-B. Tetrahedron Lett. 2001, 42, 2601
Kirin, S. I.; Wissenbach, D.; Metzler-Nolte, N. New. J. Chem. 2005, 29, 1168.
Bedford, R. B.; Cazin, C. S. J.; Holder, D. Coord. Chem. Rev. 2004, 248, 2283
Mitchell, T. N. "Organotin Reagents in Cross-coupling", Metal-catalyzed Cross-coupling Reactions (Eds. Diederich, F.; Stang, P. J.) Wiley-VCH, Weinheim, 1998. Chapter 4
Suzuki, A. "Cross-coupling Reactions of Organoboron Compounds with Organic Halides", Metal-catalyzed Cross-coupling Reactions (Eds. Diederich, F.; Stang, P. J.) Wiley-VCH, Weinheim 1998, Chapter 2
Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457
Suzuki, A. J. Organomet. Chem. 1999, 576, 147
Kotha, S.; Lahiri, K.; Kashinath, D. Tetrahedron 2002, 58, 9633
Suzuki, A. J. Organomet. Chem. 2002, 653, 83
Negishi, E.; Liu, F. "Palladium- or Nickel-catalyzed Cross-coupling with Organometals Containing Zinc, Magnesium, Aluminum and Zirconium", Metal-catalyzed Cross-coupling Reactions (Eds. Diederich, F.; Stang, P. J.) Wiley-VCH, Weinheim 1998, Chapter 1
Negishi, E.; Hu, Q.; Huang, Z.; Qian, M.; Wang, G. Aldrichimica Acta 2005, 38, 71
Hiyama, T. "Organosilicon Compounds in Cross-Coupling Reactions", Metal-catalyzed Cross-coupling Reactions (Eds. Diederich, F.; Stang, P. J.) Wiley-VCH, Weinheim, 1998, Chapter 10
Spivey, A. C.; Gripton, C. J. G.; Hannah, J. P. Curr. Org. Synth. 2004, 1, 211
Murahashi, S. I. J. Organomet. Chem
Pérez, I.; Sestelo, J. P.; Sarandeses, L. A. J. Am. Chem. Soc
Knapp, R.; Rehahn, M. J. Organomet. Chem. 1993, 452, 235.
Imrie, C; Loubser, C.; Engelbrecht, P.; McCleland, C. W. J. Chem. Soc. 1999, 1, 2513.
Jackson, R. F. W.; Turner, D.; Block, M. H. Synlett 1996, 862.
Sonogashira, K. J. Organomet. Chem. 2002, 653, 46-49.
Böhm, V. P. W.; Hermann, W. A. Eur. J. Org. Chem. 2000, 3679.
Liang, B.; Dai, M.; Chen, J.; Yang, Z. J. Org. Chem. 2005, 70, 391.
Gholap, A. R.; Venkatesan, K.; Pasricha, R.; Daniel, T.; Lahoti, R. J.; Srinivasan, K. V. J. Org. Chem. 2005, 70, 4869.
Yi, C.; Hua, R. J. Org. Chem. 2006, 71, 2535.
Kasahara, A.; Izumi, T.; Maemura, M. Bull. Chem. Soc. Jpn. 1977, 50, 1021.
Lavaste, O.; Plass, J.; Bachmann, P.; Guesmi, S.; Moinet, C.; Dixneuf, P. H. Organometallics 1997, 16, 184.
Yamamoto, T.; Morikita, T.; Maruyama, T.; Kubota, K.; Katada, M. Macromolecules 1997, 30, 5390.
Linder, E.; Ruifa, Z.; Eichele, K.; Ströbele, M. J. Organomet Chem. 2002, 660, 78
Jeffery, T. Tetrahedron Lett. 1985, 26, 2667-2670.
Calo, V.; Nacci, A.; Monopoli, A.; Laera, S.; Cioffi, N. J. Org. Chem. 2003, 68, 2929-2933.
Carlström, A.-S.; Frejd, T. J. Org. Chem. 1990, 55, 4175.
Andersson, C-M.; Hallberg, A.; Jr. Davis, G.D. J. Org. Chem. 1987, 52, 3529
Pedersen, B.; Wagner, G.; Herrmann, R.; Scherer, W.; Meerholz, K.; Schmalzlin, E.; Brauchle, C. J. Organomet. Chem. 1999., 590, 129.
Ozawa, F.; Soyama, H.; Yanaghara, H.; Aoyama, I.; Takino, H.; Izawa, K.; Yamamoto, T.; Yamamoto, A. J. Chem. Soc. 1985, 107, 3235
Lin, Y-S.; Yamamoto, A. Organometallics 1998, 17, 3466.
Colquhoun, H. M.; Thompson, D. J.; Twigg, M. V. Carbonylation Direct Synthesis of Carbonyl Compounds, New York, 1991, 26.
Sakakura, T.; Chaisupakitsin, M.; Hayahi, T.; Tanaka, M. J. Organomet. Chem. 1987, 334, 205
Ozawa, F.; Yamamoto, A. Chem. Lett. 1982, 865.
Kobayashi, T.; Tanaka, M. J. Organomet. Chem. 1982, 233, C64.
Ozawa, F.; Sugimoto, T.; Yuasa, Y.; Santra, M.; Yamamoto, T.; Yamamoto, A. Organometallics 1984, 3, 683.
Ozawa, F.; Sugimoto, T.; Yamamoto, T.; Yamamoto, A. Organometallics 1984, 3, 692
Uozumi, Y.; Arii, T.; Watanabe, T. J. Org. Chem. 2001. 66, 5272.
Tsukada, N.; Ohba, Y.; Inoue, Y. J. Organomet. Chem. 2003. 687, 436.
Skoda-Földes, R.; Szarka, Zs.; Kollár, L.; Dinya, Z.; Horváth, J.; Tuba, Z. J. Org. Chem. 1999, 64,2134.
Szarka, Zs.; Skoda-Földes, R.; Kollár, L.; Horváth, J.; Tuba, Z. Synth. Commun. 2000, 30, 1945.
Skoda-Földes, R.; Székvölgyi, Z.; Kollár, L.; Berente, Z.; Horváth, J.; Tuba, Z. Tetrahedron 2000, 56, 3415.
Szarka, Zs.; Skoda-Földes, R.; Kollár, L. Tetrahedron Lett. 2001, 42, 739.
Watanabe, M.; Araki, S.; Butsugan, Y. J. Org. Chem. 1991, 56, 2218.
Shieh, W-C.; Dell, S.; Repič, O. J. Org. Chem. 2002, 67, 2188.
Shieh, W-C.; Lozanov, M.; Loo, M.; Repič, O.; Blacklock, T. J. Tetrahedron Lett. 2003, 44, 4563.
Juneja, T. R.; Garg, D. K.; Schäfer, W. Tetrahedron 1982, 38, 551.
Wang, Y.; Rillema, D. P. Inorg. Chem. Comm. 1998, 1, 27.
Skoda-Földes, R.; Csákai, Z.; Kollár, L.; Horváth, J.; Tuba, Z. Steroids 1995, 60, 812-816
Herrick, R. S.; Jarret, R. M.; Curran, T. P.; Dragoli, D. R.; Flaherty, M. B.; Lyndiberg, S. E.; Slate R. A.; Thornton, l. C. Tetrahedron Lett. 1996, 37, 5289.
Kirin, S. I.; Schatzschneider, U.; de Hatten, X.; Weyhermüller, T.; Metzler-Nolte, N. J. Organomet. Chem. 2006, 691, 3451
Moriuchi, T.; Nomoto, A; Yoshida, K.; Ogawa, A.; Hirao, T. J. Am. Chem. Soc. 2001, 123, 68
Orpen, A.G.; Brammer, L.; Allen, F. H.; Kennard, O.; Watson, D. G.; Taylor, R. J. Chem. Soc., Dalton Trans. 1989, S1-S83
Orpen, A.G.; Brammer, L.; Allen, F. H.; Kennard, O.; Watson, D. G.; Taylor, R. second ed. International Tables for X-ray Crystallography, vol. C Kluwer Academic Publisher, Dordrecht, The Netherlands 1999, 804-888
van Steveren D. R.; Metzler-Nolte, N. Chem. Rev. 2004, 104, 5931
Moriuch, T.; Hirao, T. Chem. Soc. Rev. 2004, 33, 294
Kirin, S. I.; Kraatz, H.-B.; Metzler-Nolte, N. Chem. Soc. Rev. 2006, 35, 348
Herrick, R. S.; Jarret, R. M.; Curran, T. P.; Dragoli, D. R.; Flaherty, M. B.; Lyndiberg, S. E.; Slate R. A.; Thornton, l. C. Tetrahedron Lett. 1996, 37, 5289
Little, F. W.; Eisenthal, R. Organic and Biological Chem. 1960, 82, 1577
Sheehy, M. J.; Gallagher, J. F.; Yamashita, M.; Ida, Y.; White-Colangelo, J.; Johnson, J.; Orlando, R.; Kenny, P. T. M. J. Organomet. Chem. 2004, 689, 151
Hammond, P. J.; Beer, P. D.;
Dudman, C.; Danks,
Szarka, Z.; Skoda-Földes, R.; Kuik, A.; Berente, Z.; Kollár, L. Synthesis 2003, 545
de Hatten, X.; Weyhermüller, T.; Metzler-Nolte, N. J. Organomet. Chem. 2004, 689, 4856.
Találat: 5303