| kategória | ||||||||||
|
|
||||||||||
|
|
||
SZERVETLEN KÉMIA ALAPJAI
A világot felépítö anyagokat két nagy csoportra lehet osztani, a szervetlen és szerves anyagok csoportjára. Ma ennek már nincs jelentösége, de a szerves vegyületek 3-4 milliós nagyságrendje a 70-80 ezer szervetlen vegyülettel szemben indokolja a külön tárgyalásukat.
Elsösorban érdekesek az elemek és ezek elöfordulása, hogy azok tisztán, vagy elemi és kémiailag kötött állapotban található meg illetve azokkal, amelyek kötött állapotban vannak.
A teljesség igénye nélkül egy összefoglaló jellemzést kívánok adni azokról az elemekröl, illetve vegyületekröl, amelyek az élö szervezetekben elöfordulnak illetve az élelmiszeripar számára fontosak, különös tekintettel az élelmiszerbiztonság szempontjából a toxikus elemekre és vegyületekre.
Mai ismereteink szerint 25 elem biológia szükségességét igazolják. Hat elem
(H, C,O,N,P,S) minden földi életforma számára nélkülözhetetlen, ezekböl épülnek fel a biomolekulák. Az emberi szervezet felépítésében részt vevö elemeket két nagy csoportba szokás osztani. Azokat az elemeket, amelyek a szervezet tömegének 0,005%-nál nagyobb mennyiségben vannak jelen, azok a makroelemek (Ca, Na, K, P), amely ennél kisebb arányban van jelen, mikroelemeknek nevezzük (Fe, Zn, Cu, Mn).
35. táblázat. Az emberi szervezet átlagos ásványanyag tartalma
|
Makroelemek |
Tömeg (g/kg) |
Esszenciális mikroelemek |
Tömeg (mg/kg) |
Nem esszenciális mikroelemek |
Tömeg (mg/kg) |
|
Nátrium Kálium Magnézium Kalcium Foszfor Kén Klor |
|
Vas Flour Cink Szilicium Réz Vanádium ASzelén Mangán Jód Ón Nikkel Molibdén Krom Kobalt |
|
Rubidium Bróm Aluminium Bór Barium Titán Arany Antimon Arany Tellur Litium Cézium Urán Bizmut |
|
A mikroelemeknek két csoportjuk van: Esszenciális és nem esszenciális aszerint, hogy nélkülözhetetlenek az emberi szervezet normális müködéséhez, míg az utóbbiak szerepe nem tisztázott. Kiemelt szerepe van a víznek (de ennek ismertetése már túlnyomórészt megtörtént). Az egyes elemek aránya az emebri szervezetben is igen eltérö.
Az élö szervezetben megtalálható fémionokat biológiai szerepük szerint is csoportosíthatjuk:
*vázak és szilárd szerkezetek kialakítására alkalmasak (pl. Ca2+)
*jelátviteli folyamatokban töltéshordozók (pl. Na+ )
* biokémiai folyamatok sav bázis katalizátoraiként hidrolízises folyamatban vesznek részt (pl. Zn2+)
* elektronátviteli reakciókban a fémionok oxidált és redukált formái alapvetö szerepet játszanak( pl. Fe2+/Fe3+ )
* nagy kötési energiával rendelkezö molekulák aktiválásában vesznek részt ( pl. Fe, Cu )
36. táblázat : Az emberi szervezet összetétele tömegszázalékban
|
Elem |
m/m% |
Elem |
m/m% |
|
Oxigén Szén Hidrogén Nitrogén Kalcium Foszfor |
|
Kálium Kén Klór Nátrium Magnézium Vas |
|
Tehát az egyes elemek igen eltérö szerepeket töltenek be az emberi szervezetben.
Elemek
A legtöbb elem közönséges körülmények között szilárd halmazállapotú. A szilárd halmazállapotú elemek háromféle rácstípust alkotnak: molekularácsot, atomrácsot és fémrácsot.
Molekularácsos elemek
A molekularácsot alkotó elem molekulákat erös kovalens kötések tartják össze, de maguk a molekulák csak gyenge, van der Waals-féle erökkel kapcsolódnak egymáshoz. Ennek megfelelöen a molekularácsban kristályosodó elemek alacsony olvadás és forráspontúak, ezért többségük - nemesgázok, hidrogén, nitrogén, fluor és a klór - szobahömérsékleten gáz halmazállapotúak. A molekulaméret növekedésével a molekulák közötti kölcsönhatás is nagyobb lesz. A brom cseppfolyós, a jód pedig szilárd (de könnyen szublimál) halmazállapotú.
Ha az atomok közötti kötéstípus átmeneti jellegü, a molekularácsos elemek több módosulatban fordulnak elö, ezt polimorfiának nevezzük az egyes változatokat pedig allotróp módosulatoknak nevezzük. A kisebb molekulatömegü allotróp módosulatok olvadáspontja alacsonyabb, ezek áltaklában kevésbé stabilak. Ha szilárd állapoúiak, akkor a kristályok puhábbak, az oldékonyságuk pedig jobb lesz. Vízben általában rosszul, apoláros oldószerekben jobban oldódnak. A stabilabb elektronelrendezésü elemek nemesgázok, oxigén, nitrogén a látható fény hatására nem gerjesztödnek, ezért ezek színtelenek. Ha az atomtömeg nö, akkor a nagyobb kiterjedésü elektronburok gerjeszthetösége nö, így a periódusos rendszer oszlopaiban felülröl lefelé a szín fokozatosan sötétebb lesz, aza mélyül.
Atomrácsos elemek
Az ilyen elemek atomjait erös, irányított kötöerök tartják össze, ezéert magas olvadáspont és forráspont jellemzi öket. A háromdimenziós végtelen atomrács nagy keménységü, gyémánt. Az ilyen anyagokban az elektronok lokalizáltak, ezért elektromos szigetelök. Az atomrácsos elemek egy része átmenetet képez a fémes rács felé, ezért az ilyenek (grafit, szilícium) félvezetö tulajdonságúak. Vízben és más oldószerekben nem oldódnak és nem illékonyak.
Fémrácsos elemek
A fémrácsban az atomok szoros illeszkedésben helyezkednek el, az egymáshoz szorosan kapcsolódó rácselemek számát az atomok, térkitöltése határozza meg. A fémrács könnyen deformálható, részben a delokalizált elektronok miatt, részben, mert elcsuszhatnak egymáson a szerkezet megváltozása nélkül. ha a fémrács szabályos felépítését ötvözö elem megváltoztatja, az új elem megakadályozza rácssíkok elcsúszását, ezért a fém tulajdonságait az ötvözö elem alapvetöen megváltoztatja. A fémek vízben és más oldószerekben csak kémiai változás közben oldódnak. Ha megolvasztjuk öket, akkor egymásba oldódva létrejönnek az ötvözetek. A higannyal képzett vegyületeik az amalgámok.
Az elemek fizikai és kémiai tulajdonságait alapvetöen az elektron negatívitásuk illetve elektronszerkezetük határozza meg. Az elemek egy része elemi állapotban is megtalálható (nemesgázok, kén, oxigén, nemesfémek), a többit pedig az oxidációs állapottól függöen oxidációval ( pl. halogenidekböl Cl2 elöállítása elektrolízissel) illetve az oxidál állapotú fémeket redukcióval állítják elö ( pl. aluminum elektrolízise, vas redukciója szénnel).
Szervetlen vegyületek nevezéktanának alapjai
A vegyületeknek az un. szisztematikus nevei alapján felírható azok képlete , ill. a képletböl egyértelmüen leolvasható a vegyület neve. Ezek néha kényelmetlenül hosszúak, ezért használhatók, az un. félszisztematikus nevek is, amelyekben a vegyület egyes alkotórészeit a szisztematikus, más alkotórészeit pedig a régebbi elnevezésükkel jelölik. A szabályzat megengedi a triviális, hétköznapi nevek használatát is.
Kétfajta elemböl álló (biner) vegyületek elnevezése
Itt a rövidített vagy teljes szisztematikus nevet használjuk, amelyek még egyszerüek.
Az elektropozitív elem (a fém vagy két nemfém közül a kisebb elktronnegatvitású) változatlan neve után tesszük az elektronnegatív elem -id végzödéssel ellátott latin nevét, így nevezzük el a biner savakat is.
NaCl nátrium-klorid
CaO kalcium-oxid
HI hidrogén-jodid
ZnS cink-szulfid
*ha a vegyület képletében az egyik vagy mindkét összetevö két atommal szerepel, de az elekropozitív alkotórész állandó oxidációs számú elem:
CaCl2 kalcium-klorid
Al2O3 aluminium-oxid
*így nevezzük el az összetételük alapján ide sorolható biner savakat is.
H2S hidrogén-szulfid
*ha a vegyület képletében egy-egy atommal szerepel ugyan mindkét összetevö, de az elektropozitív alkotórész változó oxidációs számú elem:
FeO vas-oxid vagy vas(II)-oxid
Minden más esetben a teljes szisztematikus nevet kell használni, amelyet kétféle módon lehet képezni.
* vagy mindkét elem atomjainak számát a nevük elé tett görög számnevekkel jelöljük :mono-, di-, tri-, tetra-,penta-, hexa-, hepta. A mono jelölést általában elhagyjuk.
pl. As2O3 diarzén-trioxid
As2O5 diarzén-pentaoxid
SO3 kén-trioxid
*vagy az elektropozitív összetevö oxidációs számát a neve után tett kerek zárójelbe tett római számmal jelöljük:
pl. SO3 kén(VI)-oxid ( kiejtve: kén-hat-oxid)
FeO vas(II)-oxid
Al2O3 aluminium(III)-oxid
Az egyszerü ionok nevét úgy képezzük, hogy a megfelelö elektropozitív ill. elektronegatív összetevö nevéhez az ion szót kapcsoljuk:
pl. Na+ nátriumion
Ca2+ kálciumion
Cl- kloridion
S2- szulfidion
Ha az elektropozitív elem többféle iont alkot, akkor az ion töltését a zárójelbe tett római számmal tüntetjük fel:
pl. Fe2+ vas(II)ion ( kiejtve vas-kettö-ion)
Fe3+ vas(III)ion
Többfajta elemböl álló (nem biner) vegyületek elnevezése
A bonyolultabb összetételü vegyületek közül csak azokkal foglakozunk,amelynél az elektronnegatív alkotórész az összetett atomcsoport, ami néhány -id-re végzödö kivételtöl eltekintve - ilyen pl. az -OH, amely neve hidroxid; és a -CN, amely neve cianid - mindig -át végzödést kap.
*A bázisok szisztematikus elnevezésében a fém nevét hidroxid szó követi.
Pl. NaOH nátrium-hidroxid
Ca(OH)2 kálcium-hidroxid
Ha a fém változó oxidációs számú, általában a szisztematikus elnevezés következö módját használjuk:
Fe(OH)2 vas(II)-hidroxid
Fe(OH)3 vas(III)-hidroxid
Az oxosavak - vagyis ahol az anion központi atomjához csak O kapcsolódik - és sóik szisztematikus elnevezése bonyolult, ezért a gyakorlatban vegyes elnevezési rendszer használato 545g62f s.
Ha a savképzö elem csak egyféle oxidációs számmal alkot savat, ennek triviális nevét úgy képezzük, hogy az illetö elem nevéhez a sav szót illesztjük. Pl.
H2CO3 szénsav
Kivételek a szilíciumot tartalmazó kovasavak.
Ha a savképzö elem kétféle oxidációs számmal képez savat, akkor a magasabb oxidációs számút az elözö módon nevezzük el, az alacsonyabb oxidációs számú nevéhez viszont a savképzö elem nevéhez az -os, -es képzöt illesztjük. Az utóbbi példákban feltüntetjük a savak mellett a bennük szereplö összetett elektronnegatív atomcsoport (savmaradék) nevét is, amelyet úgy képezünk, hogy a magasabb oxidációs fokozatú savaknál az -át, az alacsonyabb fokozatúnál pedig az -it végzödést illesztjük a savképzö elem teljes, rövidített latin nevéhez.
H2SO4 kénsav szulfát
H2SO3 kénessav szulfit
Kivétel
HNO3 salétromsav nitrát
HNO2 salétromossav nitrit
A megfelelö ionok nevét úgy képezzük, hogy a nevekhez az ion szót kapcsoljuk:
NO3- nitrátion
NO2- nitrition
Kettönél több oxidációs számú elemek által alkotott savaknál az oxidációs szám további csökkenését a hipo-, növekedését pedig a per- szócskával jelöljük.
Pl.
HClO hipoklórossav hipoklorit
HClO2 klórossav klorit
HClO3 klórsav klorát
HClO4 perklórsav perklorát
A sók nevét a fém és a savmaradék nevének összeillesztésével képezzük:
Na2SO4 nátrium-szulfát
Na2SO3 nátrium-szulfit
KClO kálium-hipoklorit
KClO2 kálium-klorit
KClO3 kálium-klorát
KClO4 kálium-perklorát
Ha a fém nem állandó oxidációs számú, akkor a neve után megadjuk az oxidációs számot is:
Fe2(SO4)3 vas(III)-szulfát
FeSO4 vas(II)-szulfát
A komplex vegyületeknél csakis a teljes szisztematikus nevek használhatók. Gyakorlati szempontból azok a legjelentösebbek, amelyekben az elektronnegatívabb atomcsoport a komplex összetevö.
Nevükben a komplex központi atomjának nevéhez az -át végzödést kapcsoljuk, és római számmal feltüntetjük az oxidációs számát is, a ligandumok számát pedig az -o képzövel ellátott nevük elé irt görög számnevek mutatják:
K3[Fe(CN)6] kálium-[hexaciano-ferrát(III)]
K4[Fe(CN)6] kálium-[hexaciano-ferrát(II)]
Így kell elnevezni az amfoter fémek hidroxikomplexeit is:
Na2[Sn(OH)4] nátrium-[tetrahidroxo-sztannát(II)]
Na2[Sn(OH)6] nátrium-[tetrahidroxo-sztannát(IV)].
Az élelmiszeripari szempontból legfontosabb kémiai elemek, valamint szervetlen vegyületek és tulajdonságaik
Hidrogén
Elektronszerkezet: 1s1
A H a He együtt az elsö periódus eleme, elektronnegatvitása: 2,1
Kétatomos, apoláros molekulát alkot, ami stabil és a H-H kötés egyike a legerösebb kötéseknek.
Izotópjai:prócium . H (1p + 1e) , elöfordulása 99,985 %
deutérium D (1p 3 1n + 1e) , elöfordulása 0,015%
tritium T (1p +2n +1e ), β-sugárzás közben bomlik, felezési ideje 12,5 év, mennyisége elenyészö
Fizikai tulajdonságai:színtelen, szagtalan, nem mérgezö gáz. Sürüsége 14,4 -szer kisebb, mint a levegö. Kis molekulatömege miatt nagy a diffúziósebessége és a fajlagos hökapcitása, hövezetö képessége, elektromos vezetöképessége is nagy.
Apoláris molekulái között csak van der Waals-féle csekély diszperziós erök hatnak, ezért az Op.(továbbiakban olvadáspont = Op ) és Fp. ( továbbiakban forráspont = Fp.) igen kicsi. A He után a legnehezebben cseppfolyósítható gáz. Vízben kevésbé oldódik, de egyes platina fémek (Pt és Pd) oldják részben atomosan, részben ionosan, a fémekkel interszticiális hidridként. A fémekben elnyelt hidrogén aktívabb a molekuláris hidrogén gáznál, ezért a hidrogént nagymértékben elnyelö fémek jó hidrogénezö katalizátorok.
Kémiai tulajdonságai:
*pozitív oxidációs számmal csak csak kovalens kötésü, nem fémekkel alkotott vegyületeiben szerepel pl. HCl
*vizes oldatban a H+ víz molekulához kapcsolódik és oxonium ionként van jelen ( H3O+ )
* 1e- felvétellel 1s2 He héjjal rendelkezö hidridiont képez H- (alkáli és alkáli földfémekkel, LiH és LiAlH4 ) - eröteljesen redukál,
*levegön, O2 gázban vizzé ég el : 2H2 + O2 = 2 H2O,
* 2 : 1 arányú elegye a durranógáz, amely magas höm( 600 şC) vagy katalizátor jelenlétében robban ,
* H2 : Cl2 = 1:1 klórdurranógáz , H2 + Cl2 = 2 HCl ,
* fontos redukálószer. CuO + H2 = Cu + H2O,
* a fejlödö " naszcensz" H sokkal reakcióképesebb
Elöfordulása: szabad állapotban ritkán, vegyületeiben kötötten
Elöállítása:
*Zn + H2SO4 = ZnSO4 + H2
*2Na + 2 HOH = " NaOH + H2
* vízgáz reakció- C + H2O = CO + H2 450 şC -on CO + H2O = CO2 + H2
( a CO2 vízzel kimosható)
* földgázból - CH4 + H2O = CO + 3 H2
víz elektrolízise
Felhasználás:
*szervetlen vegyületek szintézise ( HCl, NH3 ), szerves szintézis ( metanol )
* növényi olajok keményítése , margaringyártás
* redukálószer
Nemesgázok
He, Ne, Ar, Kr, Xe, Rn
Elektronszerkezet: He s2, a többi s2p6
Fizikai tulajdonságai: stabil, egyatomos molekulák, amelyek a lezárt nemes gáz héj miatt nem reakcióképesek. Esetleg a részlegesen lezárt d-héjon áll rendelkezésre gerjesztett pálya a kötés kialakításához. Gáz halmazállapotú, alacsony Op. És Fp.,stabil nehezen polarizálható elektronhéjuk van. Sürüségük az atomtömegükkel arányos.
Kémiai tulajdonságai: ellenállóak
Elöállítás: levegö cseppfolyósításával és frakcionált desztillációval
Felhasználás: léggömb, világítás technika, védögáz, fénycsövek, gyógyászat
Halogének
F, Cl, Br, I
Elektronszerkezet: s2p5
Fizikai tulajdonságok:
37. táblázat: Halogének legfontosabb adatai
|
Név |
Halmazállapot |
Szín |
Elektronnegativitás |
Oxidációs szám |
|
F |
Gáz |
zöldes sárga |
|
|
|
Cl |
Gáz |
sárgás zöld |
|
|
|
Br |
Gáz |
vörös barna |
|
|
|
I |
Gáz |
sötét szürke |
|
|
A külsö elektronhéjon csak egy elektron hiányzik az elektronhéjról a stabil nemesgáz szerkezethez. Elemi állapotban kétatomos kovalens molekulákat képeznek. Nö a méret és a van der Waals erök, így sürüség nö, szín mélyül és a halmazállapot és ennek megfelelö. A szilárd jód könnyen szublimál. A halogének vízben oldásakor pedig kémiai reakció játszódik le Cl2 és Br2 esetében, míg a Br2 és I2 csak szerves oldószerekben, CCl4, CHCl3, alkohol és éter. Ezeknek a színe eltérö, de vízben nem oldódik. A I2 jellegzetes tulajdonsága, hogy a keményítövel élénk kék színt alkot ( jódkeményítö).
Élettani hatások:
A F ( kis mennyiségben szükséges a fogzománchoz) és Cl erösen mérgezö, a folyékony Br börön maró sebeket okoz, gözei is mérgezöek. A I gözök a szem és az orr nyálkahártyáját ingerlik.
Kémiai tulajdonság:
*a legstabilabb oxidációs számuk -1, más oxidációs szám csak O-el szemben,
* a F a legelektronnegatívabb, F → Cl → Br → I irányban csökken,
* H-el reagál és vegyületeiböl elvonja
H2 : Cl2 = 1 :1 klórdurranógáz ( UV, kék fény hatására robban ),
* fémekkel halogenideket alkot:
2Fe + 3 Cl2 = 2 FeCl3
* halogenidekkel a standard potenciál alapján, mindig a pozitívabb redukálódik
Cl2 + 2 KBr = Br2 + 2 KCl
![]() de 2 KCl + Br2
de 2 KCl + Br2 ![]()
![]()
* vízzel reagál:
![]() Cl2
+ H2O HCl + HClO hipoklórossav
Cl2
+ H2O HCl + HClO hipoklórossav
HOCl = HCl + O
![]() Br2
+ H2O HBr + HBrO
hipobrómossav
Br2
+ H2O HBr + HBrO
hipobrómossav
HBrO = HBr + O
I2 a vizel nem reagál, de KI jelenlétében I2 + I- = I3-( trijódion)
keletkezik komplex képzödés közben, így víz oldékonnyá válik
* lúggal ( NaOH, KOH, NH4OH ) a Cl2, Br2, I2 azonos módon reagál
Cl2 + 2 NaOH = NaCl + NaClO + H2OC + O CO, CO2
Cl2 + HOH 2HCl + "O"
katód (-): 2H+ + 2e = H2 redukció
anód (+): 2Cl- - 2e = Cl2 oxidáció
![]() 2HCl H2+Cl2
2HCl H2+Cl2
2.96500 C
katód (-): H2° + 2e = 2H+
anód (+): Cl2 + 2e = 2Cl-
Fe(s) = Fe2+ + 2 e
˝ O2(g) + H2O(l) + 2 e- 2 OH
Fe2+ + 2 OH = Fe(OH)2(s).
4 Fe(OH)2(s) + O2(g) = 2 Fe2O3ˇH2O(s) + 2 H2O(l).
vasrozsda
Zn(s) +2 MnO2(s) + 2 H2O(l) Zn(OH)2(s) + 2 MnO(OH)(s).
Zn(s) + 2 OH = ZnO(s) + H2O(l) + 2 e (anódreakció),
HgO(s) + H2O(l) + 2 e = Hg(l) + 2 OH (katódreakció).
![]() Pb(s) + HSO
Pb(s) + HSO![]() PbSO4(s) + H+
+2 e
PbSO4(s) + H+
+2 e
![]() PbO2(s)
+ 3 H+ + HSO
PbO2(s)
+ 3 H+ + HSO![]() + 2 e PbSO4(s)
+ 2 H2O(l).
+ 2 e PbSO4(s)
+ 2 H2O(l).
Cd(s) + 2 OH Cd(OH)2(s) + 2 e
![]() [NiO(OH)](s) + H2O(l) + e Ni(OH)2(s)
+ OH
[NiO(OH)](s) + H2O(l) + e Ni(OH)2(s)
+ OH
2 H2(g) + O2(g) 2 H2O(l).
2 H2(g) + 4 OH = 4 H2O(l) + 4 e (anódreakció),
O2(g) + 2 H2O(l) + 4 e = 4 OH (katódreakció).
2H2 + O2 = 2 H2O,
H2 + Cl2 = 2 HCl ,
CuO + H2 = Cu + H2O,
Zn + H2SO4 = ZnSO4 + H2
2Na + 2 HOH = " NaOH + H2
vízgáz reakció- C + H2O = CO + H2 450 şC -on CO + H2O = CO2 + H2
* földgázból - CH4 + H2O = CO + 3 H2
2Fe + 3 Cl2 = 2 FeCl3
Cl2 + 2 KBr = Br2 + 2 KCl
Cl2 + H2O HCl + HClO hipoklórossav
HOCl = HCl + O
![]() Br2
+ H2O HBr + HBrO
hipobrómossav
Br2
+ H2O HBr + HBrO
hipobrómossav
HBrO = HBr + O
Cl2 + 2 NaOH = NaCl + NaClO + H2O
nátrium-hipoklorit, Hypo
![]()
![]()
NaCl + O oxidáló hatása miatt
Elöállítás: fertötlenítöszer
* HCl oxidáció ( pl. KMnO4, MnO2 ) - Cl2
* NaCl oldat elektrolizise- Cl2
* bromidokból, jodidokból oxidálószer vagy elektrolízis - Br2, I2
Felhasználás :
*F2 - müanyaggyártás (teflon)
* Cl2 - víz és fertötlenítés, fehérítés, növényvédö szer
* Br2 - gyógyszer, vegyszer
* I2 - reagens, fertötlenítöszer (alkoholos oldata a jódtinktúra)
Hidrogénhalogenidek
HX, ahol a X = F, Cl, Br, I
A HF, HCl (vizes oldata a sósav), HBr és HI: szobahömérsékleten szúrós szagú, maró hatású gázok, komprimálva könnyen cseppfolyósíthatók, cseppfolyós állapotban nem vezetik az elektromos áramot, nem tartalmaznak ionokat. Kovalens kötésü molekulákat alkotnak, amelyek polárisak, a polaritás a HF → HI irányban csökken. Vízben jól oldódnak és meghatározott összetételü elegyük maximális forráspontú azeotrópos elegyet alkot. Oldásukkor protolitikus folyamat megy végbe:
![]() HCl + H2O
H3O+ + Cl-
HCl + H2O
H3O+ + Cl-
Teljesen disszociálnak és vizes oldatuk savas kémhatású. Legjelentösebb belölük a HCl.
Hidrogén-klorid (HCl)
Vizes oldata a sósav. Szintelen, szúrós szagú gáz, ala csony a forráspontja. Vízben jól oldható, vele 20,24 5-ban azeotrópos elegyet alkot. Tömény vizes oldata erösen füstölög. A forgalomba kerülö legtöményebb oldat 38 5-os, az un. háztartási sósav 10 %-os. A HCl : HNO3 = 3 : 1 elegye a királyvíz, amely az aranyat és platinát is oldja. A sósav a negatív standarpotenciálú fémeket H2 fejlödés közben oldja, ( pozitív potenciálút nem ! )
Zn + 2 HCl= ZnCl2 + H2
Elöállítás:
* szintézissel H2+ Cl2 = 2 HCl
* NaCl + H2SO4 = NaHSO4 + HCl hidegen
* NaHSO4 + NaCl = Na2SO4 + 2 HCl melegítve
Felhasználás:
*fémfelületek tisztítása, labor vegyszer, festék és gyógyszeripar
Oxigéncsoport
Oxigén, kén, szelén , tellur
Elektonszerkezete: s2p4
Az oxigén tulajdonságai eltéröek a csoport többi tagjától. Az oszlopon lefelé haladva az elektronnegatívitás csökkenésével párhuzamosan a nemfémes jelleg is gyengül, csak az oxigén és a kén az igazi nemfémes elem, a szelén félfém és a tellúr pedig fém.
38. táblázat. Az oxigén csoport elemeinek legfontosabb adatai
|
Név |
Elektronnegativitás |
Oxidációs szám |
|
Oxigén |
|
|
|
Kén |
|
|
|
Szelén |
|
|
Fizikai tulajdonságok:
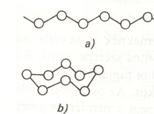 A csoport tagjaiban nagyobb eltérések vannak, mint a halogéneknél
illetve a nemesgázoknál. Ennek oka az elektronszerkezetben keresendö: két
kötést kell létrehozni a stabilis elektronoktett kialakításához. Amíg ezt az
oxigén nagy elektronnegativitása és atomjainak kis mérete miatt kettös kötés kialakításával éri
el, így kétatomos molekulákat képez, addig a többi elemnél minden atom további
másik két atommal létesít kötést, amire két lehetöség is van. Az egyik
lehetöség többatömos, gyürüs molekula kialakítása a kénnél (S8)
és a metastabil vörös szelénnél (Se8). A másik lehetöség
végtelen atomláncok képzödése a szelén stabilis, un. fémes ( vagy szürke)
módosulatánál:
A csoport tagjaiban nagyobb eltérések vannak, mint a halogéneknél
illetve a nemesgázoknál. Ennek oka az elektronszerkezetben keresendö: két
kötést kell létrehozni a stabilis elektronoktett kialakításához. Amíg ezt az
oxigén nagy elektronnegativitása és atomjainak kis mérete miatt kettös kötés kialakításával éri
el, így kétatomos molekulákat képez, addig a többi elemnél minden atom további
másik két atommal létesít kötést, amire két lehetöség is van. Az egyik
lehetöség többatömos, gyürüs molekula kialakítása a kénnél (S8)
és a metastabil vörös szelénnél (Se8). A másik lehetöség
végtelen atomláncok képzödése a szelén stabilis, un. fémes ( vagy szürke)
módosulatánál:
68. abra: A S és Se lehetséges molekulái
a) végtelen lánc
b) S8 és Se8
Jelentkezik a csoportnál az allotrópia: egy elemnek ugyanabban a halmazállapotban eltérö szerkezetü és eltérö fizikai, kémiai tulajdonságú módosulata létezik.
39. táblázat : A csoport fontosabb allotróp módosulatai
|
Elem |
Módosulat |
Szerkezet |
Szín |
Megjegyzés |
|
|
Oxigén |
(di)oxigén |
O2(g) |
színtelen |
szagtalan gáz |
|
|
Ózon |
O3(g) |
halványkék |
szúrós szagú gáz |
||
|
Kén |
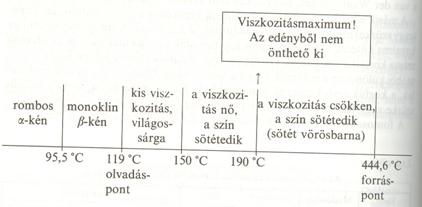
Rombos α-kén |
S8(s) |
sárga |
95,5 ş C alatt |
A két módosulat eltérö kristályrácsában S8 molekulák |
|
Monoklin β-kén |
S8(s) |
sárga |
95,5 ş C felett |
||
|
Szelén |
Vörösszelén |
Se8(s) |
vörösbarna |
metastabil, nem fémes módosulat |
|
|
fémes, szürke szelén |
végtelen láncok(s) |
szürkés-fehér |
stabil, fémes módosulat |
||
Oxigén
Fizikai tulajdonságai
Színtelen, szagtalan gáz, kétatomos molekulákat alkot, amelyben egy σ és egy π kötés található. Vízben gyengén oldódik (1 dm3 vízben csak ≈ 30 cm3 oxigén, de ez a vízi élölény szempontjából nélkülözhetetlen), az ózón elég jól oldódik.
Kémiai tulajdonságai:
Az oxigén kémiai tulajdonságaiban jelentösen eltér a csoport többi tagjától. Az oxidációs száma -2, de kivételt képeznek a peroxidok, ahol ez -1. Ennek oka az
▬0▬O▬ peroxokötés, így más atomokkal mindegyik oxigén csak egy kötést tud létesíteni.
Az oxigén a fluor után a legelektronnegatívabb elem. Az oxigén molekula kettös kötése miatt azonban szobahömérsékleten kevésbé aktív, mint a klór, magas hömérsékleten azonban reakcióképes . A halogenidek, a nemesgázok és néhány nemesfém kivételével minden elemmel reagál közvetlenül. Az alkálifémeket már szobahömérsékleten oxidálja. Nedvesség jelenlétében más fémeket is megtámad (lassú oxidáció), de a felületen keletkezett tömör oxidréteg sok fémnél megakadályozza a folyamat továbbhaladását (pl. alumínium eloxálás). A vasnál viszont a oxidréteg (rozsda) laza szerkezetü, nincs védö hatása.
A fém-oxidok általában bázisanhidridek, vízzel bázisokká egyesülnek, a nem fém oxidok viszont savanhidridek, vízzel savakká egyesülnek. Ezeket a savakat a hidrogén-halogenidekkel szemben - mivel a savmaradék oxigént tartalmaz- oxosavaknak nevezzük.pl.
4Na + O2 = 2 Na2O Na2O + HOH = 2 NaOH
bázisanhidrid bázis
C + O2 = CO2 CO2 + HOH = H2CO3
savanhidrid sav
2 NaOH + H2CO3 = Na2CO3 + 2 H2O
só
Az atomos oxigén sokkal reakcióképesebb, mint a molekuláris oxigén.
Az ózon is azért különösen reakcióképes, mert könnyen bomlik naszcensz oxigén keletkezése közben. A tiszta ózon e bomlékonysága miatt robbanásveszélyes:
O3 = O2 + O
Élettani hatásuk:
Az oxigén az élö szervezetek nélkülözhetetlen éltetö eleme. A természetben a növények asszimilációja következtében keletkezik:
6 CO2 + 6 H2O = C6H12O6 + 6 O2
Ez a folyamat biztosítja a
levegö szén-dioxid és oxigén tartalma között fennálló egyensúlyt. Az ózon
erösen mérgezö volta ellenére is igen fontos a földi élet
szempontjából. A légkör magasabb rétegeiben (25
Elöállitásuk:
*O2 a levegöben 21 v/v%, levegö cseppfolyósítása és frakcionált desztillációja,
* O tartalmú anyagok höbontása
* ozonizátor.- két elektród között nagy feszültségü elektromos kisülés 5-10 % O3 keletkezik O2-böl
Felhasználás
* O2 -- hegesztés, gyógyászat
* O3 - fertötlenítöszer, fehérítöszer
Kén
Fizikai tulajdonságai:
Sárga színü, rombos és monoklin kén formájában található, vízben nem oldódik, de CS2-ben (szén-diszulfidban) igen jól oldódik. A kén jellegzetes viselkedését hevítés hatására az alábbiak mutatják. A viszkozitás változásának a magyarázata az, hogy míg a kén olvadékában 150 şC-ig az S8 molekulák gyürüs szerkezetüek, 150 şC-tól kezdve a gyürüs molekulák a hömozgás hatására kezdenek felhasadni, a keletkezett láncok összefonódnak és ezzel a viszkozitást növeli. A láncok hossza 190 şC körül a legnagyobb. Ennél nagyobb hömérsékleten a láncok kezdenek széttöredezni, ami a viszkozitás csökkenését vonja maga után. A forráspontjáig hevített ként hideg vízbe öntve, nyúlós, gumiszerü amorf kén keletkezik, ami részben oldódik szén-diszulfidban.
A kén igazi nemfémes elem.
Kémiai tulajdonságai:
A kén fémekkel és nem fémekkel reagál, szulfidokat hoz létre, amelyek tiosavként és tiobázisként foghatók fel (A tio szó a kén görög nevéböl származik). Az alkáli- és alkáliföldfém - szulfidok ionos kötésü vegyületek, míg a d mezö szulfidjai kovalens és oldhatatlan színes csapadékot alkotnak.
Na2S + H2S = 2 NaSH As2S3 + 3 H2S = 2 H3AsS3
tiobázisanhidrid tiobázis tiosavanhidrid tiosav
3 NaHS + H3AsS3 = Na3AsS3 + 3 H2S
tiosó
Fémekkel szulfidokat alkot: HgS a hömérö Hg tartalmának a megkötése törés esetén. A kén a fehérjék alkotó része, de mérgezö vegyülete a H2S.
Elöállitás
* elemi állapotban elöfordul, bányásszák
Felhasználás:
* kaucsuk vulkanizálás
* hordók kénezése-fertötlenítés
Hidrogén-peroxid : H2O2
Fizikai tulajdonságai:
Színtelen, szagtalan, víznél másfélszer sürübb folyadék. Vízzel minden arányban elegyedik. Molekulái polárosak és közöttük H-híd kötés alakul ki. Hevítésre, ütésre robbanásszerüen bomlik:
2 H2O2 = 2 H2O + O2
Vizes oldata is bomlékony, 30% felett robbanás veszélyes. Jellegzetes reakciói:
2I- + H2O2 + 2H+ = I2 + 2 H2O
2 MnO4- + 5 H2O2 + 6 H+ = 2 Mn2+ + 5 O2 + 8 H2O
Felhasználása
* színtelenítö, fertötlenítöszer, oxidálószer
Kénhidrogén: H2S
Fizikai tulajdonságai:
Színtelen, kellemetlen, záptojás szagú gáz. Rendkívül erös méreg, töményebb állapotba belélegezve ájulást, majd halált okoz. Vízben jól oldódik, vizes oldata a kénhidrogénes víz, ami analitikai reagens.
Kémiai tulajdonságai
* Éghetö és erélyes redukálószer,
2 H2S + 3 O2 = 2 SO2
kevés levegö jelenlétében 2 H2S + O2 = S + 2 H2O
* gyenge sav, kismértékben disszociál két lépcsöben
![]() H2S H+ + HS- K1 = 10 -7
H2S H+ + HS- K1 = 10 -7
![]()
HS- H+ + S2- K2 = 1,3.10-13
* fémekkel fém-szulfidokat illetve hidrogén-szulfidokat alkot, amelyek oldhatósága eltérö ( ez képezi az ionkimutatás alapját)
Elöállítás:
* fémszulfid + HCl
Felhasználás:
* analitika
Kén fontosabb oxidjai és oxosavai
Kén-dioxid, SO2
Fizikai tulajdonságai:
Színtelen, szúrós szagú gáz. Könnyen cseppfolyósítható, a cseppfolyós kén-dioxidnak nagy a párolgáshöje.
Kémiai tulajdonságai:
*Nem éghetö, az égést nem táplálja. Vízben kénessav keletkezése közben igen jól oldódik, a kénessav anhidridje:
![]() SO2
+ H2O H2SO3
SO2
+ H2O H2SO3
*Redukáló hatású:
I2 + SO2 + 2H2O = 2HI + H2SO4
A növényi festékeket elszíntelenít, ez azonban nem mindig a redukáló hatás következménye, hanem bomlékony, színtelen addíciós termék keletkezése. Igen erös méreg, tisztán belélegezve halált okoz, de kisebb koncentrációban is ártalmas a légzöszervekre. A növények is érzékenyek rá, különösen a tülevelüek. A mikroorganizmusok növekedését is gátolja, ezért lehet fertötlenítésre használni.
Elöállítása:
* kén égetése
* szulfidos ércek pörkölése
Felhasználása:
* kénsav gyártás
* fertötlenítés
Ként-trioxid, SO3
Fizikai tulajdonságai:
Közönséges hömérsékleten színtelen, nagy sürüségü, levegön erösen füstölgö folyadék, amely könnyen polimerizál és szilár anyaggá alakul.
Kémiai tulajdonságai:
*vízzel rendkívül hevesen egyesül kénsavvá:
SO3 + H2O = H2SO4
* de kénsavban is oldódik, dikénsav keletkezése közben
SO3 + H2O = H2S2O7
Elöállítás:
* kén-dioxid katalitikus oxidációjával
Kénsav: H2SO4
Fizikai tulajdonságai:
Színtelen, nagy sürüségü, nem illékony folyadék. Vízzel minden arányban elegyedik. Az elegyedés igen erös felmelegedéssel jár, amit vízzel alkotott hidrátjainak exoterm képzödése okoz. A kénsav hígítását ezért nagy elövigyázatossággal kell végezni, úgyhogy mindig a vízbe öntjük a kénsavat és nem fordítva. A tömény kénsav oldat erösen nedvszívó, higroszkópos, levegön állva a levegö nedvességtartalmától is felhígul. A kénsav és a víz 98,3 m/m%-os összetételü, 338 şC-on forró azeotrópos elegyet alkot, bepárlással tehát vízmentes kénsav nem állítható elö.
Kémiai tulajdonságai:
Erös kétbázisú sav, disszociációja két lépésben játszódik le:
![]() H2SO4 HSO4- + H+
H2SO4 HSO4- + H+
![]() HSO4-
SO42- + H+
HSO4-
SO42- + H+
A kétfokozatú disszociációnak megfelelöen a kénsavból két sorozat só vezethet le:. hidrogén-szulfátok (pl. NaHSO4 ) és szulfátok ( pl. Na2SO4).
Mint az egyik legerösebb, nem illékony sav, gyakorlatilag az összes savat fel tudja a sóiból szabadítani. A hidrogénnél negatívabb standarpotenciálú fémeket hígított állapotban is oldja H2 gáz keletkezése közben: pl.
2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
Forró, tömény állapotban is igen erös oxidálószer, ezért a hidrogénnél pozitívabb standardpotenciálú fémek egy részét (réz, ezüst, higany) is oldja, fém-szulfátok és kén-dioxid fejlödése közben: pl.
Cu + 2 H2SO4 = CuSO4 + SO2 + 2 H2O
Az aranyat és platinát nem támadja meg.
Erös vízelvonó hatása miatt az emberi, állati és növényi szöveteket elroncsolja, szerves anyagokat (p.l cukor) elszenesíti.
Elöállítása:
Kén oxidációjával illetve a pirit pörkölésével, dikénsavat állítanak elö, amelyet tetszés szerinti töményre lehet hígítani.
Felhasználása:
* mütrágya (szuperfoszfát) elöállítása, foszforsav elöállítása
* gázok szárítása
* szerves szintézis, gyógyszeripar, nitrálószer, szulfonálószer
* laboratóriumi reagens és szárítószer
Nitrogéncsoport
Nitrogén, foszfor, arzén, antimon, bizmut
Elektronszerkezete:s2p3
A nitrogén tulajdonságai éppúgy eltérnek, mint az oxigén esetében. A nemfémes jelleg csökken erösen a rendszám növekedésével. Az oszlop elemeinek több allotróp módosulata lehetséges.
40. táblázat. A nitrogéncsoport elemeinek legfontosabb adatai
|
Név |
Elektronnegatvitás |
Oxidációs szám |
|
Nitrogén |
|
-3 és +5 között bármi értéket felvehet |
|
Foszfor |
|
|
|
Arzén |
|
|
Fizikai tulajdonságai:
A nitrogéncsoport elemeinek külsö elektronhéján a szerkezet alapján három kovalens kötést kell létesíteniük a stabilis nemesgáz szerkezet kialakításához. A nitrogén nagy elektronnegatítvitása és atomjainak kis mérete miatt kétatomos molekulát képez hármas kötéssel:
![]()
A kis molekulatömeg miatt az Op. és Fp kicsi. A hármas kötés az elemi gázok molekulái közül legállandóbbá teszi a N2 molekulát, így a nemesgázokat leszámítva a legkevésbé reakcióképes elem, noha elekronnegativitása igen nagy. Az oszlop többi elemeinél egy atom három másik atomhoz kapcsolódik. Ez két módon valósulhat meg. Az egyik mód valódi (diszkrét) molekulák képzödése a nemfémes módosulatokban (sárgafoszfor, sárgaarzén). A P4 molekulák tetraéder alakúak, aminek négy csúcsán helyezkednek el az atomok, mindegyik egy-egy kovalens kötést létesít a másik három atommal: A másik mód végtelen rétegek és ezekböl rétegrácsok (kétdimenziós atomrácsok) kialakulása, amely a foszfor kivételével stabil:
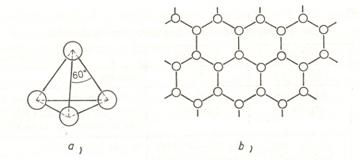
69.ábra : P4 molekulák (a) és atomrácsok kialakulása az arzénnál (b)
A foszfor stabilis módosulatánál a vörös- vagy ibolyafoszfornak speciális láncokat tartalmazó egydimenziós atomrácsa van, amely lánc a tetraéder alakú P4 molekulák összekapcsolásával keletkezik:
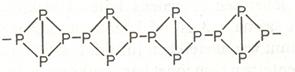
Itt is minden atomnak megvan a három kovalens kötése.
41. táblázat. A nitrogéncsoport elemeinek fontosabb allotróp módosulatai
|
Elem |
Módosulat |
Szerkezet |
Megjelenési forma |
|
Nitrogén |
(di)nitrogén |
N2 |
színtelen gáz |
|
Foszfor |
fehér-vagy sárga foszfor |
P4- tetraéder |
tiszta állapotban fehér, metastabil |
|
vörös- vagy ibolyafoszfor |
P4-tetraéderekböl összekapcsolt lánc |
ibolyásvörös, stabil |
|
|
feketefoszfor (fémes foszfor) |
rétegrács |
fekete, metastabil |
|
|
Arzén |
sárgaarzén |
As4-tetraéder |
sárga, instabil |
|
szürkearzén (fémes arzén) |
rétegrács |
szürke, stabil |
Nitrogén
Fizikai tulajdonságai:
A nitrogén vízben az oxigénnél gyengébben oldódik (így a vízben oldott levegö összetétele megváltozik). A levegö 78 v6v%-át alkotja.
Kémiai tulajdonságai:
Külsö elektronhéjának megfelelöen három elektron felvételével érhetö el a nemesgáz konfiguráció, és elvileg 5 elektron leadására van lehetöség. Így oxidációs száma -3 és +5 lehet. A H-el három kovalens kötést alakít ki az NH3-ban. A N 3+ oxidációs állapotú vegyületei könnyen oxidálódnak +5 oxidációs állapotúvá. Ezért állandóbbak a salétromsav (HNO3 és származékai), mint a +3 oxidációs számú salétromossav (HNO2 és származékai). A csoport legkevésbé reakcióképes eleme N2 levegön nem gyújtható meg és az égést nem táplálja. Legfontosabb reakciója, hogy 400-500 şC-on, nagy nyomáson, katalizátor jelenlétében ammóniává alakulása:
![]() N2
+ 3 H2 2
NH3
N2
+ 3 H2 2
NH3
Élettani hatása:
A nitrogéngáz nem mérgezö, tiszta nitrogénben az élö szervezetek csak az oxigén hiánya miatt pusztulnak el. Kötött állapotban nélkülözhetetlen az élethez, a fehérjék aminosavakból épülnek fel.
Elöállítása:
Levegö cseppfolyósításával és frakcionált desztillációval.
Foszfor
Kémiai tulajdonságai:
A csoport legreakcióképesebb eleme a foszfor, a fehér foszfor tüzveszélyes és csak víz alatt tartható el. Gyulladási hömérséklete kb. 60, de levegön állva a szobahömérsékleten lejátszódó lassú oxidáció miatt melegítés nélkül is eléri a gyulladási hömérsékletet, öngyulladás következik be, finom eloszlásban pedig már szobahömérsékleten is azonnal meggyullad. A vörösfoszfor gyulladási hömérséklete jóval nagyobb, kb. 400 şC, így ez már nem tüzveszélyes.
Élettani hatás:
A foszfor módosulatai közül a szerves anyagokban (pl. zsírokban) jól oldódó fehérfoszfor erösen mérgezö (0,1g már halálos mérgezést okoz), gözeinek belégzése is súlyos mérgezést idézhet elö. A vörösfoszfor nem mérgezö, mert oldhatatlan. Kötött állapotban a foszfor az összes nukleinsavban, valamint sok fehérjében van jelen.
Felhasználása:
* gyufagyártás,
* foszforsav elöállítás.
Nitrogén hidrogénvegyületei
H2N-NH2 (hidrazin) és NH2-OH ( hidroxilamin)
A hidrazin folyadék, a hidroxilamin szilárd halmazállapotú vegyület, vizes oldatuk lúgos kémhatásúak és eröteljes redukálószerek:
NH2-NH2 → ox → N2 + H2O
NH2-OH → ox → N2 + H2O
Elönyösen alkalmazhatók, mert a reakciótermékek nem károsak.
NH3 ( ammónia)- leggyakrabban alkalmazott
Fizikai tulajdonságai:
Színtelen, szúrós szagú, a levegönél sokkal kisebb sürüségü könnyeztetö gáz, nagyobb mennyiségben belélegezve maró hatást gyakorol a nyálkahártyára és a tüdöre. Az ammónia piramis alakú molekulái erösen polárisak. Közöttük cseppfolyós és szilárd halmazállapotban H-híd kötések alakulnak ki. Az ammónia ezért könnyen cseppfolyósítható és nagy a párolgáshöje. A cseppfolyós ammónia vízhez hasonlóan jó oldószer, az oldott sók ionjaikra disszociálnak benne, söt az alkáli és alkáli földfémeket kémiai változás nélkül fel tudja oldani.
Kémia tulajdonságai:
Az ammóniagáz vízben rendkívül jól oldódik (1dm3 víz 700 dm3 ammóniát old fel 20 şC-on), közben az alábbi egyensúlyra vezetö reakció játszódik le:
![]() NH3
+ H2O NH4+
+ OH-
NH3
+ H2O NH4+
+ OH-
A hidroxidionok miatt az oldat lúgos kémhatású. Az ammónia vizes oldata gyenge lúgként viselkedik. Az ammónia datív kötéssel protont köt meg, tehát bázis.
Az NH3és a HCl vizes oldatban is, és gázhalmazállapotban is reagál egymással, sürü fehér füstöt képez, ez az ammónium-klorid:
NH3 + HCl = NH4 Cl.
Az NH3 a d-mezö fémionjaival komplexet képez:
AgCl + 2 NH3 = Ag[(NH3)2]Cl.
Természetben nitrogéntartalmú anyagok, fehérjék bomlásakor keletkezik .
Elöállitása:
![]() N2
+ 3H2 2 NH3
N2
+ 3H2 2 NH3
* szintézis körülményei 500 ş C, vas katalizátor és 21-200 MPa nyomás.
Felhasználása:
* mütrágya, salétromsavgyártás, robbanószer, hütöberendezés
Nitrogén oxidjai és oxosavai
NO, NO2 és N2O4
A nitrózus gázok közül a legfontosabbak a NO, NO2 és N2O4 . Ezek maró hatású, mérgezö anyagok, elegyüket nitrózus gázoknak vagy nitrózus gözöknek nevezzük. Különösen veszélyes levegöszennyezök (savas esö, füstköd, rákkeltö anyagok keletkezése).
N2 + O2 = 2 NO 3000 ş C
villámlás hömérsékletén ,színtelen gáz
Könnyen oxidálódik
2NO + O2 = 2 NO2 vörösbarna gáz
Könnyen dimerizál:
![]() 2NO2
N2O4
2NO2
N2O4
színtelen , illékony folyadék
Salétromossav, HNO2
Bomlékony, középerös sav, csak híg vizes oldata állítható elö, ami kék színü.
Kémiai tulajdonságai:
Általában oxidáló hatású (ilyenkor NO vagy NH3 keletkezik belöle), de erös oxidálószerek (pl. KMnO4) salétromsavvá oxidálják, ekkor tehát redukálószerként viselkedik. Sói a nitritek, állandóbbak és tisztán, kristályos állapotban elöállíthatók. Közülük az alkálifém-nitritek a stabilak (KNO2, NaNO2, amit pác sóként is alkalmaznak).
Salétromsav, HNO3
A salétromsav vízmentes alakban színtelen, nagy sürüségü, a levegön füstölgö folyadék. Vízzel minden arányban elegyedik és vele 69,2 m/m%-os azeotropos elegyet alkot. Már híg vizes oldatban is teljesen disszociál, igen erös sav.
Kémiai tulajdonságai:
Erös oxidálószer, ezért a tömény salétromsav még a hidrogénnél pozitívabb standardpotenciálú fémek közül is felold néhányat (rezet, ezüstöt, higanyt), ez azonban nem H2 fejlödés közben megy végbe. A salétromsav ugyanis elöször oxidálja fémet, miközben a sav töménységétöl függöen föként, NO (≈ 30%) vagy NO2 ( 50% felett ) keletkezik:
3 Ag + 4 HNO3 = 3 AgNO3 + NO + 2 H2O
Ag + 2 HNO3 = AgNO3 + NO2 + H2O
Az aranyat és a platinát nem oldja, ezért nevezték választóvíznek. Az arany és a platina is oldódik a királyvízben, amely HNO3 : HCl = 1 : 3 elegye. Itt naszcensz klór keletkezik, ami eröteljesen oxidál:
HNO3 + 3 HCl = NOCl + 2Cl + 2 H2O
nitrozil-klorid (NOCl) és atomos Cl együttesen tudja oxidálni az aranyat és platinát.
Bizonyos, hidrogénnél negatívabb standardpotenciálú fémek (pl. vas, alumínium, króm) híg salétromsavban oldhatók, de tömény salétromsavban nem. Ennek oka, hogy a fém felületén védö oxidréteg keletkezik, ami megvédi továbbihatástól (a fém passziválódik).
Xantoprotein-reakció: a salétromsav a szerves vegyületeket roncsolja, aromás aminosavakat tartalmazó fehérjékkel sárga színezödést ad (börön is észlelhetö).
Elöállítása:
* NH3 oxidációjával
Felhasználása:
* mütrágya, robbanószer, szerves szintézis, gyógyszeripar.
Foszfor oxidjai és oxosavai
P2O3 és P2O5
A foszfor +3 és +5 oxidációs számmal szerepel az oxidjaiban: P2O3 a difoszfor-trioxid, míg a P2O5 a difoszfor-pentaoxid. Valamennyi oxid színtelen, szilárd halmazállapotú anyag. A P2O5 még a tömény kénsavból is képes vizet elvonni.
Kémiai tulajdonságai:
A P2O5 vízzel, ennek mennyiségétöl függöen foszforsavat képez. A foszfor oxidációs száma mindegyikben +5, csak a savak víztartalma eltérö:
P2O5 + H2O = 2 HPO3 metafoszforsav (sói metafoszfátok)
P2O5 + 2 H2O = H4P2O7 pirofoszforsav (sói a pirofoszfátok)
vagy difoszforsav
P2O5 + 3H2O = 2 H3PO4 ortofoszforsav - foszforsav- (sói a foszfátok).
Mindhárom sav szilárd halmazállapotú. Közülük legfontosabb és legstabilabb az ortofoszforsav. Ha elegendö víz van jelen, mindig ez keletkezik, víz jelenlétében a másik két sav is ortofoszforsavvá alakul át. Ezért a foszforsav elnevezés mindig ortofoszforsavat jelent.
Foszforsav, H3PO4
A foszforsav tiszta állapotban színtelen, könnyen olvadó kristályos anyag, igen erösen nedvszívó, levegön szirupsürüségü folyadékká alakul. Vízben jól oldódik. Középerös sav, három lépcsöben disszociál és így háromféle aniont szolgáltat: H2PO4- (dihidrogén-foszfát-ion) HPO42- (hidrogén-foszfát-ion) és PO43- (foszfátion). Ennek megfelelöen három sorozat sót is alkot. 80-90%-os vizes oldat alakjába kerül forgalomba.
Elöállítása:
P4 + 5 O2 = 2 P2O5 + H2O → H3PO4
Felhasználás:
* foszfor mütrágyák, zománc
* üdítöital, foszfátok- állománystabilizálók .
Széncsoport
Szén, szilícium, germánium, ón, ólom
Elektronszerkezet: s2p2
A csoportban a szén nemfémes elem, a szilícium szintén, de már félfémekre utaló tulajdonságai vannak, a germánium félfém, az ón és ólom pedig kifejezetten fémek.
Szén és szilícium
Fizikai tulajdonságok:
Külsö elektronhéjuk felépítése alapján elemi állapotban négy kötést kell létesíteniük a nemesgáz konfiguráció eléréséhez, amelyben az atomok összes külsö elektronjainak részt kell vennie. A gyémántban, szilíciumban, germániumban és a szürkeónban sp3 hibridizációval egy tetraéderes szerkezet alakul ki, a rács pedig minden irányban kovalens kötésekkel összetartott atomrács. Az erös kovalens kötés miatt magas Op. és Fp. nagy keménységü és oldószerekben oldhatatlan elemeket jelentenek.
Kémiai tulajdonságaik.
A C és a Si mindig +4 oxidációs számmal szerepelnek a vegyületeikben, és ez azt is jelenti, hogy néhány kivételtöl eltekintve mindig négy kovalens kötést hoznak létre.
A C vegyületekre az is jellemzö, hogy bennük a szén atomok hosszú láncokat és gyürüket is képezhetnek, kis méretük és aránylag nagy elektronnegativitásuk miatt pedig egymáshoz nemcsak σ-, hanem π- kötésekkel is kapcsolódhatnak kettös, ill. hármas kötést alkothatnak). Ezekkel, a vegyületekkel a szerves kémia foglalkozik.
A szénhez hasonlóan a szilíciumatomok is kapcsolódhatnak egymással láncokat alkotva (szilíciumhidrogének vagy szilánok), ezek stabilitása azonban kicsi, és a leghosszabb lánc is csak 6 szilícium atomot tartalmazhat.
A szénnek
(carbónium) két allotróp módosulata létezik, a termodinamikailag metastabil
gyémánt és a stabil grafit. Újabban fedezték fel a
A gyémánt tiszta állapotban színtelen, átlátszó, igen erösen fénytörö. Sürüsége nagy (3,31 g/cm3), Op. igen magas. Négy σ kötés van benne, a legkeményebb természetes anyag, az elektromos áramot nem vezeti. Kémiailag igen ellenálló, de magas hömérsékleten az oxigénnel szén-dioxiddá ég el.
A grafit fekete, átlátszatlan, fényes anyag. Sürüsége jóval kisebb a gyémántnál, Op. szintén magas. Igen lány anyag, az elekromosságot jól vezeti, elsörendüen elektronokkal. Tulajdonságai a szerkezetével magyarázható. Három szénatommal σ-kötést létesít negyedik elektronja delokalizált π-kötést alakít ki a rács sikjában. A hatszöges gyürürendszerben a szénatomokat erös kovalens kötések kapcsolják össze, amelyet a delokalizált π-kötések tovább erösítenek, ezért nagy olvadáspont és nem illékony. A párhuzamos rácssíkok között gyenge van der Waals kötöerök hatnak, ezért a rácssíkok könnyen elmozdulnak, tehát puha anyagot kapunk. A nem lokalizált π-elektronokkal magyarázható a grafitnak a fémekhez hasonlóan nagy elektromos és hövezetése.
A grafit rácsában tehát az atomrácson kívül már a fémes rács és a molekularács bizonyos sajátságai is megtalálhatók. Szerkezetileg a mikrokristályos grafit a különbözö eljárásokkal mesterségesen elöállított un. amorf szén - aktív szén, korom - is. A mesterséges szenek közül fontos a koksz.
Közönséges hömérsékleten a grafit nem reakcióképes, magas hömérsékleten azonban oxigénnel ez is szén-dioxiddá ég el.
A természetben a szén sokkal nagyobb mennyiségben fordul elö vegyületeiben, mint elemi állapotban. Az ásványi szén nem tiszta elemi szén, hanem különbözö bonyolult szénvegyületek és elemi szenek keveréke.
A szilícium sötétszürke, fémes csillogású, nagy Op-ü, kemény, kristályos anyag. Elektromos vezetöképessége tiszta állapotban csekély, ezt azonban már igen kis mennyiségü szennyezö anyag is megnövelheti (a félvezetö tulajdonság fellépése miatt).
Közönséges hömérsékleten kevéssé reakcióképes, csak a fluorral reagál. Magas hömérsékleten az oxigénnel szilícium-dioxiddá ég el. Savakkal szemben ellenálló, lúgokban H2 fejlödés közben oldódik:
Si + 2 NaOH + H2O = Na2SiO3 + 2 H2
Természetben, elemi állapotban nem fordul elö, csak a vegyületei formájában: SiO2 a homok valamint a szilikátok.
Szén oxidjai
Szén-monoxid , CO
Fizikai tulajdonságai:
A szén-monoxid színtelen, szagtalan, nehezen cseppfolyósítható gáz, vízben alig oldódik. Fizikai tulajdonságai hasonlítanak a nitrogénhez, aminek oka, hogy ezek, un. izoszter vegyületek (a két molekulában azonos az atomok, elektronok és neutronok száma, valamint az elektronok elrendezése). Azonban az N2 gázzal ellentétben a CO rendkívül erös méreg. Hosszú idön át belélegezve már 0,1% CO tartalmú levegö is halálos mérgezést okozhat. A CO a hemoglobinhoz kapcsolódik és vele stabil szén-monoxid-hemoglobint alkot, ezáltal a hemoglobin elveszti az O2 kötö és közvetítö képességét.
Kémiai tulajdonságai:
* a CO meggyújtva halványkék lánggal CO2-vé ég el
2CO + O2 = 2 CO2
* nagyobb hömérsékleten eröteljes redukálószer
Fe2O3 + 3CO = 2 Fe + 3 CO2
*egyes fémekkel komplex, bomlékony karbonil-vegyületet képez
4 CO + Ni = Ni(CO)4
Elöállítása:
![]() * C + O2 2 CO (generátorgáz)
* C + O2 2 CO (generátorgáz)
* C + H2O = CO + H2 (vízgáz)
* CH4 + H2O = CO + 3 H2 (szintézisgáz)
Felhasználás:
* kohászat, redukció, szerves szintézis
Szén-dioxid, CO2 és szénsav, H2CO3
Fizikai tulajdonságai:
A szén-dioxid színtelen, szagtalan, enyhén savanykás ízü gáz. A levegönél mintegy 1,5-szer nehezebb. Szobahömérsékleten 3,5 MPa nyomáson színtelen, könnyen mozgó folyadékká cseppfolyósitható, ami szürke acélpalackba kerül forgalomba.
A cseppfolyós szén-dioxid molekula légköri nyomáson erösen párolog, és mivel nagy a párolgáshöje, erösen lehül, miközben szilárd hószerü tömeggé fagy meg ( szárazjég vagy "szénsavhó"). Hömérséklete az erös párolgás miatt állandóan
-78 ş C marad, ezért kitünö hütöanyag.
A szén-dioxid molekula stabilis, nem reakcióképes, az égést nem táplálja az égö gyertya elalszik benne). Nagyobb mennyiségü szén-dioxid belégzése az állati, ill. emberi szervezetre ártalmas és veszélyes, mert felhígítja a légzéshez szükséges oxigéntartalmat, így halált okoz. Szén-dioxid jelenlétében az alkohol hamarabb szívódik fel a vérben.
Jól oldódik vízben és részben szénsavvá alakul:
![]() CO2
+ H2O H2CO3
CO2
+ H2O H2CO3
A szén-dioxid tehát a szénsav anhidridje, a reakció megfordítható, melegítés hatására a szénsav elbomlik, és szén-dioxid távozik.
Elöállítása :
* CaCO3 + 2HCl = CaCl2 + CO2 + H2O
* mészégetés CaCO3 = CaO + CO2
Felhasználás:
* élelmiszeripar: üdítöital és hütöközeg
* lángelfojtó (tüzoltó készülék)
Szénsav, H2CO3
A szénsav csak híg vizes oldatban ismeretes. Közepesen erös sav, mivel azonban a szén-dioxid szénsavvá alakulása (az elöbbi reakció kismértékü), ezért a szénsav csak gyenge savként viselkedik. Két lépésben disszociál:
![]() H2CO3
H+ + HCO3-
H2CO3
H+ + HCO3-
![]() HCO3-
H+ + CO32-
HCO3-
H+ + CO32-
Ennek megfelelöen két sorozat sója ismeretes, ezek a hidrogén-karbonátok (pl. KHCO3) és a karbonátok ( pl. K2CO3).
Ciánvegyületek
A C és N atom között létrejövö hármas kötés (amelyet egy σ- és két π- elektronpár hoz létre) igen stabilis. A keletkezett CN gyököt ciángyöknek nevezzük.
A ciángyök legjellemzöbb tulajdonsága az elemi halogénekhez való kémiai hasonlósága. Szénatomjának párnélküli elektronja révén egy kovalens kötés kialakítására képes, egy elektron felvételével pedig egy negatív töltésü cianidionná alakul ( CN-).
Dicián (CN)2
Két ciángyök egymáshoz kapcsolódva, színtelen, szúrós és keserümandula szagú, igen mérgezö gáz, dicián keletkezik. Lúgokkal hasonlóan reagál, mint a halogének
(CN)2 + 2 KOH = KCN + KOCN + H2O
kálium-cianid kálium-cianát, a ciánsav sója
Hidrogén-cianid (HCN) és sói
Színtelen, keserümandula szagú, alacsony hömérsékleten forró, rendkívül mérgezö hatású folyadék.
Sói a cianidok, amelyek közül a legfontosabb a nátrium-cianid (NaCN) és kálium-cianid (KCN). A KCN fehér színü, keserümandula szagú anyag, amelyböl már a szénsav is felszabadítja a HCN, ezért a KCN és NaCN rendkivül erös méreg !
A cianidion sok átmeneti fémmel erös komplexet képez. A cianidok mérgezö hatása is ezzel a komplexképzö sajátsággal függ össze, mert a vér hemoglobinjában levö vassal komplex vegyületet alkotnak, így meggátolják az oxigén szállítását.
A tiociánsav (HSCN) sóit, a kálium-tiocianátot (KSCN) vagy az ammónium-tiocianátot (NH4SCN) a vas (III)-ion kimutatására használják, a keletkezö Fe(SCN)3 ugyanis vörös színü és vízoldékony vegyület.
Szilícium-dioxid és kovasavak
A SiO2 a földünkön a legelterjedtebb ásvány, három kristályos módosulta létezik, mint a kvarc, tridimit és krisztobalit. A kvarc kavics és homok formájában igen nagy mennyiségben van a természetben.
A kvarc 1700 şC hömérsékleten megömlesztve üvegszerü anyaggá dermed. UV sugarakat átengedi és gyors höváltozásokat kibír. Vízben és savakban oldhatatlan, csak a HF támadja meg. NaOH-val fözve lassan nátrium-szilikáttá alakul:
SiO2 + 2 NaOH = Na2SiO3 + H2O
A SiO2 formális savanhidrid, belöle a különbözö kovasavak vezethetök le, ezek azonban a szilícium-dioxid és víz reakciójával nem állíthatók elö.
A kovasavak alapvegyülete az ortokovasav, H4SiO4. Az ortokovasav nem állandó, molekulái vízkilépés közben polisavakat képeznek, amelyek közül a diortokovasav a legegyszerübb.
2H4SiO4 = H6Si2O7 + H2O
A diortokovasav sem állandó, hanem a kondenzáció (vízkilépés) tovább folytatódik, egyre nagyobb molekulák, majd végtelen polikovasav láncok és rétegek alakulnak ki, egyre kevesebb víztartalommal. Így polikovasavak keveréke keletkezik, amelynek nincs pontos sztöchiometriai összetétele, csak az x SiO2.y H2O általános képlettel jellemezhetö.
A kovasavak, szilikátok és szilícium-dioxid SiO4-tetraéderekböl épülnek fel. A szilícium-dioxidban minden SiO4-tetraéder négy másikhoz kapcsolódok egy közös O atommal, vagyis minden O atom két Si atomot köt össze, így adódik a SiO2 összetétel.
Bór
Elektronszerkezete: s2p1
Fizikai tulajdonságai.
A gyémánt után a legkeményebb anyag, Op. 2030ş C Fp. is magas. Sötétszürke, fémfényü kristályok vagy barnás fekete mikrokristályos por alakjába ismeretes. Félvezetö, nagy a neutronelnyelö képessége.
Kémiai tulajdonságai:
Reakcióképessége viszonylag kicsi, oxigénben hevítve bór(III)-oxiddá alakul, ami tömény salétromsavval bórsavvá oxidálható.
Természetben szabadon nem fordul elö, csak vegyületei: bórax és bórsav.
Bórsav (ortobórsav, H3BO3)
Gyöngyházfényü, színtelen kristályokat alkot. Hideg vízben kevéssé, meleg vízben elég jól oldódik. Hevítéskor vizet veszít és metabórsavvá alakul (HBO2) illetve tetrabórsavvá alakul (H2B4O7).
Nátrium-tetraborát (dinátrium-tetraborát, Na2B4O7 x. 10 H2O)
A természetben legnagyobb mennyiségben elöforduló bórvegyület. Fehér színü kristályos anyag, meleg vízben jól oldódik. Vizes oldata a hidrolízis miatt lúgos kémhatású. Az üveg és zománcgyártásnál használják.
Fémek
A fémek közül elemi állapotban csak a nemesfémek fordulnak elö, a többieket a vegyületeikböl, amelyben oxidált formában találhatók, állítják elö. A fémek elöállítása általában redukcióval történik.
Fémek fizikai tulajdonságai:
A fémek már vékony rétegekben is átlátszatlanok, jellegzetes fémes fényük abból ered, hogy a rájuk esö fény nagy részét visszaverik. Színük a sárga színü arany és vörös színü réz kivételével általában szürkésfehér, finom eloszlásban azonban valamennyi fém sötét színü. A fémek szobahömérsékleten szilárdak a higany kivételével.
A fémek valamennyien kristályosak, kristályrácsukban a pozitív fémionok között a kötést a nem lokalizált elektronok felhöje, az ún. elektrongáz hozza létre. Ezért a fémes kötés nem irányított jellegü, aminek következtében a fémek rács szerkezete egyszerü.
A legtöbb fém a szabályos rendszerben kristályosodik. 12-es koordinációs számú lapközepes (a), vagy 8-es koordinációs számú térben, középpontos kockarácsban (b) de jelentös a hexagonális rendszerben kristálysodó fémek száma is (c) a 64.ábrán.
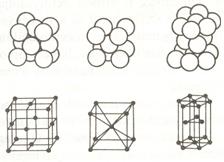
64. ábra. A különbözö rácstípusok a) lapközepes, b) térközepes
és c) hexagonál rácsok
Egyes fémeknek több allotróp módosulata is elöfordul (pl. vas, mangán) és hö hatására a kristályszerkezet módosulás is elöfordulhat.
A fémeket a sürüségük alapján könnyüfémekre és nehéz fémekre oszthatjuk:
ς könnyüfémek < 5 g/cm3 <ς nehézfémek
alkáli és alkáli földfémek összes többi fém
legkisebb sürüségüek legnagyobb sürüségü
( ς<1 g/cm3) ozmium ( ς = 22,48 g/cm3)
Li, Na, K
A fém rácsból következö jellegzetes tulajdonság a rugalmasság és a képlékenység. A rugalmassági határ alatt a deformáló merö megszünte után a fémek visszanyerik eredeti alakjukat, a rugalmassági határ felett maradandó alakváltozást szenvednek.
A fémek olvadáspontja és forráspontja az anyagi minöségtöl függöen széles határok között változik. Jól vezetik a höt és elektromossságot.
A fémek oldószerekben fizikailag nem oldódnak, csak kémiai úton (pl. savakban vegyületté alakulnak). Kivételes a cseppfolyós NH3, amely az alkálifémeket képes oldani. A megolvasztott fémek egymásba oldódnak, ötvözeteket képeznek. A fémeknek Hg-al képzett ötvözetei az amalgámok.
A fémeket a szerint lehet csoportosítani, hogy hol helyezkednek el a periódusos rendszerben: s-mezö, p-mezö, d-mezö és f-mezö fémei.
Fémek kémiai tulajdonságai:
A fémek savakkal szemben mutatott viselkedését alapvetöen a standard potenciáljuk alapján lehet megállapítani.
Az oxidációhoz kapcsolódva néhány fontosabb megállapítás:
*Az oxidáció hatására tömör oxidréteg keletkezik, ami megvédi a fémeket a további behatástól (pl. Al )
* a kevésbé nemes fémek, a réz, ezüst és higany salétromsavban oldhatók:
3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
tömény kénsav hasonlóan oldja:
2 Ag + 2 H2SO4 = Ag2SO4 + SO2 + 2 H2O
* az arany és platina csak királyvízben vagy HCN-ben oldódnak
![]()

![]() oxidáló
hatású savak hatása
oxidáló
hatású savak hatása
* standardpotenciálon kívül egyéb tényezö is befolyásolja az oldást, egyes nem nemes fémek nem oldódnak salétromsavban, mert a felületen összefüggö oxidréteg alakult ki, passziválódott a fém ( pl. Cr, Al )
* más esetekben a fém oldása nem következik be, mert a felületen oldhatatlan csapadék keletkezik
![]() Pb
+ H2SO4 == PbSO4
+ H2
Pb
+ H2SO4 == PbSO4
+ H2
Néhány fontosabb fém és azok legfontosabb vegyületeinek jellemzése.
s-mezö fémei
Alkálifémek:Li, Na, K, Rb, Cs, Fr
Elektronszerkezet: ns1
Fizikai tulajdonságaik:
Elektronszerkezetük alapján a legreakcióképesebb, a legkisebb elektronnegativitású és a legelektronnegatívabb elemek. Külsö elektronhéjukon egyetlen elektronjukat leadják, +1 töltésü stabil ionokat képeznek. Tipikusan ionos kötésü vegyületeket alkotnak, amelyek vízben jól oldhatók. Elektronjuk könnyen gerjeszthetö, ezért a lángfestésük jellemzö színü: Li - kárminvörös, Na - narancs sárga, K-fakóibolya, Rb- vörös, Cs-kék
Kémiai tulajdonsága:
Halogénekkel tüztünemény közben egyesülnek. Nagy reakcióképességük miatt felületüket oxid, illetve nedves levegön hidroxid réteg vonja be. Az alkálifémeket petróleum alatt tartják. Legerösebb redukálószerek:
4 Li + O2 = 2 Li2O
2 Na + O2 = Na2O2
Hidrogénnel hidrideket képeznek: pl. LiH
A vizet szobahömérsékleten hevesen bontják:
2 K + 2 H2O = 2 KOH + H2
A hidroxidjaik a legerösebb bázisok: NaOH, KOH.
Élettani hatás:
K és Na vegyületek formájában nélkülözhetetlenek a szervezetben: sav - bázis egyensúly, ozmozis nyomás , enzimek aktivátorai
Elöfordulás
* csak vegyületeikben: NaCl- kösó, Na2CO3 - szóda, NaNO3 - chilei salétrom
Alkáliföldfémek:Be, Mg, Ca, St, Ba Ra
Elektronszerkezetük: ns2
Fizikai tulajdonságaik:
Alkálifémek után a legreakcióképesebb elemek, mindig +2 oxidációs számmal szerepelnek . Két elektron leadásával stabil, nemesgáz szerkezetü ionokat képeznek. Az ionos kötés mellett megjelenik a kovalens kötés is. Jellemzö lángfestést találunk: Ca- téglavörös, Sr- kárminvörös, Ba- fakózöld.
Kémiai tulajdonságaik:
Fehér színü, friss vágási felületükön csillogó fémek, levegön gyorsan oxidálódnak. Sürüségük nagyobb, mint az alkálifémeké, de könnyü fémek. Oxigénben és levegön elégethetök. A Mg lassabban, de a többi fém bontja a vizet szobahömérsékleten:
Ca + 2 H2O = Ca(OH)2 + H2.
Élettani hatás:
*Ca és Mg az élö szervezetben nélkülözhetetlen, csontok, enzimek aktivátorai
Elöfordulás:
Vegyületek formájában- CaCO3, MgCO3, Ca(OH)2 - erös bázis
p-mezö elemei:
Elektronszerkezet: ns2p1
Aluminium, Al
Fizikai tulajdonságai:
Az alumínium a csoport legfontosabb eleme. Az alumínium ezüstfehér, könnyen nyújtható, hengerelhetö könnyüfém.
Kémiai tulajdonságai:
Erösen negatív standardpotenciálú, kis elektronnegativitású, vegyületeiben +3 oxidációs számmal szereplö fém felületét összefüggö oxidréteg vonja be, amely ellenálló (eloxálás). Amfoter jellemü fém: savban és lúgban egyaránt oldódik H2 fejlödés közben:
2 Al + 6 HCl = 2 AlCl3 + 3 H2
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
Elöfordulás:
* vegyületeiben, szilikátok, kriolit, Al2O
Elöállítás:
* bauxit, timföld elektrolízise
Óncsoport:
Elektronszerkezet: ns2p2
Ón(Sn ), ólom (Pb)
Fizikai tulajdonságai:
Az ónnak több allotróp módosulata létezik: szobahömérsékleten ezüstfehér, fémes fényü β-ón, 13,2 ş C alatt a gyémánthoz hasonló α-ón, 161 ş C felett pedig a rideg törékeny γ-ón.
Az ólom sötétszürke, friss vágási felületén fehéren csillógó, nagy sürüségü lágy fém.
Kémiai tulajdonságai:
Az ón felületén vékony oxidréteg keletkezik, ezért levegön ellenálló. Amfoter: savban és lúgban oldódik H2 fejlödés közben:
Sn + 2 HCl = SnCl2 + H2
Sn + 2 NaOH + 2 H2O = Na2[Sn(OH)4 ] + H2
Tömény salétromsav nem oldja, mert a felületén összefüggö oxidréteg keletkezik.
Az ólom nem amfoter. Bár negatív standardpotenciálú, nem oldható HCl-ben, mert oldhatatlan PbCl2 keletkezik, kénsav esetében oldhatatlan PbSO4, így csak HNO3-ban oldódik, Pb(NO3)2 keletkezik NO2 fejlödése mellett. Felületén a levegön oxidréteg keletkezik, szénsav jelenlétében pedig oldhatalan bázisos ólom-karbonát-réteg.
Élettani hatás
* ólom mérgezö
Felhasználása:
* vas lemezek korrózió elleni bevonása ónnal, konzervdoboz belsö bevonata az Sn az élelmiszeriparban
* Pb vízvezeték csövek
d-mezö elemei
Elektronszerkezet: ns2(n-1) d 1-10
A d-mezö elemeinél a külsö s-alhéjának kiépülése után az elözö, eggyel kisebb fökvantumszámú héj üresen levö d-alhéja kezd feltöltödni. Az elektronhéjak közötti kis különbség miatt a felépülés sorrendjében olykor kivételek vannak.
Néhány kivételtöl eltekintve nagy olvadáspontú és kemény nehézfémek találhatók. Az s- és d- elekronok miatt gyakran változó vegyértéküek. Általában nem képeznek nemesgázhéjú ionokat, kationjaik d-elektronokat tartalmaznak, színesek, leszámítva azokat, amelyekben a d-alhéj 10 elektronnal be van töltve.
Egyszerü kationok helyett gyakran képeznek komplex kationokat, nagy oxidációs számmal pedig oxoanionokat. Vegyületeik között sok az átmeneti kötésü, atomrácsos jellegü.
Néhány legfontosabb elem: Fe, Co, Ni, Cu, Ag, Au, Zn , Cd, Hg
Fe, Co, Ni
Fizikai tulajdonságai
A triád eleme: Fe, Co és Ni. A vas tiszta állapotban lágy és nyújtható, nikkel lágyabb, a kobalt pedig szívósabb. Az elemek ferromágnesesek, mágneses tulajdonságukat a külsö mágnenses tér megszünése után is megtartják.
Kémiai tulajdonságai:
Kémiailag közepesen reakcióképesek, a kobalt és nikkel levegön nem változik, mivel felületükön vékony oxidréteg védelmet nyújt. Száraz levegön a vas sem változik, de nedves levegön már szobahömérsékleten is korrodálódik: rozsdásodik (különbözö vas-oxidok és hidroxidok keletkeznek) amelyek szerkezete laza, nem véd meg a további oxidációtól.
Standardpotenciáljuk negatív, híg savakban H2 fejlödés közben oldódnak, legnehezebben a nikkel . A tömény salétromsav mindegyiket passziválja.
Vegyületeiben a vas +2 és +3 oxidációs számmal fordul elö 8 halványzöld, illetve halványsárga) Fe2+ és Fe3+ionként. A kobalt általában Co2+-kationként szerepel és vegyületei rózsaszínek. A nikkel legfontosabb ionja a Ni2+, amely zöld. Mindhárom elem gyakran fordul elö komplex vegyületekben.
Élettani hatás:
* élö szervezetekben nélkülözhetetlenek a biokémiai folyamatokban
* laboratóriumi eszközök anyagai
Nemesfémek :Cu, Au , Ag
Fizikai tulajdonságai:
A réz vöröses színü, az ezüst fehéren csillogó, az arany pedig sárga színü nemesfém. Meglehetösen lágyak, különösen az arany, igen jól nyújthatók és hengerelhetök, valamennyi fém közül az arany nyújthatósága a legnagyobb, utána következik az ezüsté.
Mindhárom fém jól oldódik higanyban, amalgám képzödése közben. Az összes fém közül a legnagyobb a hövezetésük és az elektromos vezetöképességük. Legjobb vezetö az ezüst, majd a réz és utána következik az arany.
Kémiai tulajdonságai:
A réz felületét nedves levegön zöld színü, összefüggö réteg (bázisos-réz-karbonát, ún. patina) vonja be. Az ezüst a levegön nem oxidálódik, de H2S - tartalmú levegöben felületén fekete színü ezüst-szulfid-réteg képzödik. Az arany a levegön változatlan marad.
Nemesfémek, elektrokémiai standardpotenciáljuk sokkal pozitívabb, mint a hidrogéné, vízböl és savakból ezért nem fejlesztenek hidrogént, nem oxidáló savakban nem oldódnak. Oxidáló savak, mint pl. a salétromsav és a forró tömény kénsav feloldják a rezet és az ezüstöt ( NO, NO2 illetve SO2 ) fejlödik. Az arany csak királyvízben oldódik, ahol a nitrozil klorod és a naszcensz klór AuCl3 alakban oldja.
A réz elsösorban +2-es (ritkábban +1-es) oxidációs számmal, az ezüst +1 -es, az arany pedig +3-as oxidációs számmal fordul elö. A réz(II)-vegyületek kék színüek, az ezüstvegyületek színtelenek és az arany vegyületek általában sárga színüek.
Természetben az arany elemi állapotban is elöfordul. Az ezüstvegyületeket ciánlúgozással állítják elö, ekkor Na [Ag(CN)2] keletkezik, amiböl kinyerik az ezüstöt.
Felhasználás:
* laboratóriumi tégelyek, elektródok, Ag vegyületek baktericidhatásúak
*Au dísztárgyak (az aranyötvözetek aranytartalmának megadására a karárátot vagy ezreléket használják ( a színarany 24 karátos illetve 1000 ezrelékes, a 14 karátos arany 584 ezrelékes), elektromos csatlakozó
Cinkcsoport: Zn, Cd, Hg
A lezárt d-alhéjuk a rézcsoporttal ellentétben nem vesz részt a vegyületképzésben, kevésbé tekinthetök átmeneti fémeknek. Mivel vegyértékelektronként csak a külsö héj s-elektronjai szerepelnek, a cink és kadmium csak +2-es oxidációs számmal szerepel. A higany is +2-es oxidációs számú, de léteznek higany(I) vegyületek is, amelyekben ▬Hg▬Hg▬ kötések vannak. Ezek a vegyületek könnyen diszproporcionálódnak és higany(II)ion és fém higany keletkezik. A lezárt d-alhéjuk miatt színtelenek.
Fizikai tulajdonságai:
A cink és a kadmium kékesfehér színü, meglehetösen lágy fém, mindkettö könnyen megolvasztható és elgözölögtethetö. A higany ezüstösen csillogó folyadék szobahömérsékleten. A higany jellegzetes tulajdonsága, hogy sok fémet felold amalgám keletkezése közben.
Kémiai tulajdonság:
Sok komplex vegyületet képeznek és higany kivételével reakcióképesek. A cink és a kadmium nem oxidáló híg savakban is oldódik hidrogénfejlödés közben, a cink azonban amfoter, savban és lúgban oldódik hidrogén fejlödése közben:
Zn + 2HCl = ZnCl2 + H2
Zn + 2NaOH + 2 H2O = Na2[Zn(OH)4].
Levegön nem változnak, mert jól tapadó oxidréteg keletkezik a felületükön. A higany pozitív standardpotenciálú fém, ezért csak oxidáló savak (salétromsav vagy forró kénsav oldja).
3 Hg + 8 HNO3 = Hg(NO3)2 + 2 NO + 4 H2O
Hg + 2 H2SO4 = HgSO4 + SO2 + 2 H2O
A higany gözei rendkívül mérgezök, a kiömlött higanyt kénporral kell beszórni.
Felhasználás:
* Zn és Cd ötvözö elem, Zn korrózió elleni védelem, ötvözetek
* Hg nyomásmérö és hömérö töltése
15. 1 Oldatos feladatok
1. Hány g NaCl és víz szükséges 3 dm3 16 m/m%-os oldat elkészítéséhez, ha a 16 m/m%-os oldat sürüsége 1,175 g/cm3 ?
m = r V = 3000 cm3 1,175 g/cm3 =
m/m% definició
3525 x g NaCl
x =
Víz mennyisége :
3525 g
2. Mennyi kristályos magnézium-szulfátot kell lemérni, hogy 115 6,36 m/m%-os magnézium-szulfát oldatot nyerjünk ?
Mr MgSO4=120 gmól-1 Mr MgSO4 x H2O = 246 gmól-1
6,36 m/m%
definíciója:
115 x
x =
Az anyag kristályos formában áll rendelkezésre
x
x =
3. Hány m/m%-os az az oldat Na2CO3-ra
nézve , amelyet úgy készítettünk, hogy
MrNa2CO3 = 106 gmól-1 , Mr Na2CO3 x 10 H2O = 286 gmól-1
r=1,000 g/cm3
, így 1.00 cm3 =
oldat tömege :
5 x
x
= 1,
x
x
=
4. Készítsünk a r = 1,55 g/cm3 sürüségü 64,71 m/m%-os kénsav oldatból 900 cm3 r = 1,09 g/cm3 sürüségü 13,36 m/m%-os kénsav oldatot vízzel való hígítással. Hány cm3 tömény kénsav oldat és hány cm3 víz szükséges az oldat elkészítéséhez ?
A készítendö 900 cm3 oldat tömege: m = V r = 900 cm3 1,09 g/cm3=981 g.
13,36 m/m% definíció alapján :
981 x
x
=
ez oldat formában van , amely 64,71 m/m% kénsavat tartalmaz
x 131,06
x
=
Az oldatot térfogatra tudjuk mérni, így V = m/r = 202,5 g / 1,55 g/cm3 = 130,66 cm3kénsav oldat, víz mennyisége = 900 cm3 - 130,66 cm3 = 769, 44 cm3.
5. Hány g 10 m/m% és 96 m/m%-os oldatból készíthetünk
A keverési szabály : m1 c1 + m2 c2 = m3 c3, ahol m1,m2 és m3 az oldatok tömegei, g -ban és c1, c2 és c3 az oldatok koncentrációi m/m%-ban. (Speciális esetekben, ha vízzel hígitok, akkor c = 0 m/m%, ha vízmentes szilárd anyaggal, akkor 100 m/m%, kristályvizes anyagnál pedig kiszámítható az anyag m/m%-os hatóanyag tartalma).
m1 = x g m2 = 200 - x g m3
=
c1 = 10 m/m% c2 = 96 m/m% c3 = 30 m/m% H2SO4
x + 96 200 - x
10x + 19200 - 96x = 6000
86x = 13200
x =153,4 g
ez adja a 10
m/m%-os kénsav mennyiségét, a 96 m/m%-os kénsavé pedig 200 - 153,4 =
6. 5 dm3 65,2 m/m%-os kénsav oldatot, amelynek a sürüsége r = 1,56 g/cm3, úgy akarjuk vízzel hígítani, hogy 17 m/m%-os kénsav oldatot kapjunk. Mennyi vízbe kell a kénsavat beleönteni?
5 dm3 =
5000 cm3, az oldat tömege m = 5000 cm3 1,56 g/cm3 =
7800 x
x
=
A hígított
oldat 17 m/m%-os
x 5085,6
x =
A víz mennyisége:
7.
60 m/m% -os oldat
5000g x
x =
a 60 m/m%-os oldat
definíciója
x
x =
Eltávolítandó víz
mennyisége : 5000g -
8. Hány g HNO3 van 200 cm3
Mr HNO3 = 63 gmól-1
mólos oldat definíció felhasználásával
* elöször koncentrációt változtatom
1000
cm3
1000 cm3
x
=
* térfogatot változtatom
1000 cm3
200 cm3 O,1 M oldatban x
x
=
9. Hány mólos az az oldat, amelynek 300 cm3-ében
MrKOH = 56 gmól-1
Mólos oldat esetében mindig 1000 cm3-re számoljuk át.
300 cm3 oldatban
1000 cm3 x
x =
Mólos oldat
definíció 1000 cm3
1000 cm3 x 10,5
x
=
Az oldat 0,625 mól/ dm3 koncentrációjú.
10. Menny a 20 m/m%-os HCl oldat koncentrációja mól/dm3-ben, ha az oldat sürüsége 1,1 g/cm3.
Mr HCl =36,5 gmól-1
20 m/m%-os oldat
definíciója
de kiszámolható az oldat térfogata : V = m/ r = 100g/ 1,1 g/cm3 = 90,90 cm3 , de a benne levö anyag mennyisége nem változik meg
90,90 cm3 oldatban 20gHCl
1000cm3 x
x
=
mólos oldat
definíció 1000 cm3
1000
cm3 x
x = 6,03 mól/ dm3
11. Hány m/m% NaOH tartalmaz a
MrNaOH = 40 gmól-1
1000 cm3
1000 cm3
x
=
az oldat tömege m =
V r = 1000 cm3 1,08 g/cm3 =
100 x
x =
12. Hány m/v% -os az
MrHCl = 36,5 gmól-1
1000 cm3
1000 cm3
x
=
1000 cm3
100 cm3
13. 120 cm3 1,1 g/cm3
sürüségü 18 m/m%-os NaCl oldatból vizzel való hígítással
MrNaCl = 58,5 gmól-1
az oldat tömege , m
= V r = 120 cm3 1,136 g/cm3 =
100 oldatban
136,32 x
x =
1000
cm3
1000 cm3
x
=
1000 cm3
x
x = 524 cm3
14. Hány mólos az az oldat, amelyet 80 cm3 35 m/m%-os és r = 1,344 g/cm3 sürüségü KOH oldatnak 400 cm3-re való hígításával nyerünk ?
MrKOH = 56 gmól-1
|
80 cm3 35 m/m%-os KOH oldat |
![]()
H2O
![]()
|
400 cm3 |
víz hozzáadásával a KOH mennyisége , g-ban marad, de ez 400 cm3oldat térfogatban lesz
m = V .ρ = 80 cm3 ?1,344 g/ cm3 =107,52 g
107,52 x
x =
400 cm3 oldatban
1000 cm3 x
x =
1000 cm3
1000 cm3 x
x =
15. Készítsünk 370 cm3
MrH3PO4 = 98 gmól-1
1000 cm3
1000 cm
x =
van 60 m/m% -os oldat
x
x
=
V = m
/ρ =
16. Hány mólos az a salétromsav oldat, amelyet vízzel ötszörös végtérfogatra hígítva, egy 9,26 m/m%-os ρ = 1,05 g/cm3 sürüségü oldatot kapunk ?
Ötszörös hígítás : V2 = 5. V1 , ahol V1 az eredeti térfogat ( pl. 200 cm3),
V2 a hígított térfogat ( pl. 1000 cm3).
|
200 cm3 eredeti oldat, ? M ( V1 ) |
![]()
H2O
![]()
|
1000 cm3
hígított oldat, 9,26 m/m% ρ = ( V2) |
MrHNO3=63 gmól-1
M = V . ρ =
1000 cm3 . 1,105 g/cm3 =
x =
de ez van az eredeti oldat 200 cm3-ében
200 cm3
oldat
1000 cm3 x
X
=
1000 cm3
1000 cm3
x
x =
17. Hányszoros végtérfogatra kell hígítani a dm3-enként
Mr ecetsav = 60 gmól-1
1000 cm3
1000 cm3
x
=
1000 cm3
x
x = 26 666 cm3
Hígítás = végtérfogat/ eredeti térfogat = 26 666 cm3 / 1000 cm3 = 26,666
18. Összeöntünk
Mrkénsav = 98 gmól-1
1000 cm3
1000 cm3
x
=
az oldat térfogata
V = m/ρ =
1000cm3
1298,7 cm3
x =1272 g H2SO4
a víz
sürüsége 1g/cm3, 3000 cm3 =
oldat tömege :
100 g x
x
=
oldat térfogata : 3000 cm3 + 1298,7 cm3 = 4298,7 cm3
4298,7 cm3 oldat
1000 cm3 x
x
=
1000 cm3
1000 cm3 x
x
=
19. Hány g Na2CO3 x 10 H2O
-ot kell bemérni
MrNa2CO3 = 106 gmól-1 , MrNa2CO3 x 10 H20 = 286 gmól-1 MrH2O = 1 gmól-1
1 n/n%-os oldat definíciója:
100 mól oldatban 1 mól Na2CO3 és 99 mól H2O
1.106 g Na2CO3 és 99 .18 g H2O
100 mól oldat tömege:
x
=
de ez kristályos formában van :
x 14,03
x
=
víz mennyisége :
20. Hány n/n%-os a
MrHCl = 36,5 gmól-1 MrH2O = 18 gmól-1
1000 cm3 1M HCl
1000 cm3 2M HCl x
x
=
oldat tömege : m =
V. ρ = 1000 cm3 x 1,035 g/cm3 =
nHCl = 73 /36,5 = 2 nH2O = 962/18 = 53,44
XHCl = nHCl / nHCl + nH2O = 2 / 2 + 53,44
XHCl= 0,036
n/n% = XHCl . 100 = 0.036 . 100
n/n% = 3,60 3,6 n/n% HCl
21. Hány m/v% és mólos a 65 m/m%-os salétromsav oldat, ha sürüsége ρ = 1,30 g/cm3. Mennyi az oldat n/n%-os összetétele ?
MrHNO3 = 63 gmól-1 MrH20 = 18 gmól-1
ennek térfogata : V = m/ρ = 100g/1,30 g/cm3 = 76,92 cm3
76,92 cm3
100 cm3 x
x
=
100 cm3
1000 cm3 x
x
=
1000 cm3 1M
1000 cm3 x 845
x =
nHNO3 = 65/63=1,0317 nH2O = 35/18 = 1,9444
X HNO3 = nHNO3 / n HNO3 + nH2O
X = 1,0317/1,0317 + 1,9444
XHNO3 =0,3467
n/n%HNO3 = 100 . XHNO3 = 100 x 0,3467
n/n%HNO3 = 34,67 34,67 mól% HNO3
22.
MrZnSO4 x 7 H20 = 387,3 gmól-1 MrZnSO4 = 261,3 gmól-1 Mr H2O = 18 gmól-1
x
=
100 oldat
x 33,73
x =
Keverési szabály alkalmazásával:
A kristályos ZnSO4 m/m%-os ZnSO4 tartalma:
387,3g ZnSO4 x 7 H20
100 g x
x = 67,46 m/m% ZnSO4
m1 =
c1 = 67,46 m/m% ZnSO4 c2 = 0 m/m% ZnSO4 c3= 2m/m%ZnSO4
(mindig kiszámítandó) ( víz )
m1.c1 + m2 . c2 = m3 . c3
50 . 67,46 + x .0 = 2 ( 50 + x )
x =
A keletkezö
oldat tömege:
23.
MrNa2CO3 x 10 H20 = 286 gmól-1 MrNa2CO3 = 106 gmól-1
100g x
x
=
ρvíz
= 1 g/cm3 , így 250 cm3 víz =
Oldat tömege:
100 x
x
=
24. Milyen lesz az oldat kémhatása, ha
MrH2SO4 = 98 gmól-1 MrNaOH = 40 gmól-1
x
=
x
=
H2SO4 + 2 NaOH = Na2SO4 + 2 H20
20 g H2SO4 x y 20 g NaOH
x =
NaOH maradék:
lúgos lesz az oldat
25. Milyen lesz az oldat kémhatása, ha 200 cm3
1000 cm3
1000 cm3
200 cm3
x =1,96 g H2SO4 y = 0,02 mól H2SO4
1000 cm3
1000 cm3
200 cm3 0,3M x y
x
=
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
98g H2SO4 2 ?
40 =
x 0,02 y
x =
Marad :
26. Ezüst-nitrát oldathoz sósavat öntünk, és ezüst-klorid
csapadék válik ki.
MrAgCl = 143,3 gmól-1
nAgCl = 0,287/143,3 = 0,002
HCl + AgNO3 = AgCl + HNO3 egyenlet értelmében
1 mól HCl 1 mól AgNO3 1 mól AgCl
x y 0,002
x = 0,002 mól HCl y = 0,002 mól AgNO3
1000 cm3 1M 1 mól AgNO3
1000 cm3 0,1M 0,1 mól
x 0,002
x = 20 cm3
1000 cm3 1M 1 mól HCl 100 % 20 cm3 HCl oldat
1000 cm3
y 0,002 y = 21.00 cm3 0,1M HCl oldat
y = 20 cm3
27. 25 cm3 2 mól/dm3 koncentrációjú Pb(NO3)2 oldat hány g 98 m/m%-os H2SO4 oldattal reagál és hány g PbSO4 csapadék keletkezik ?
MrPbSO4 = 303,1 gmól-1
Pb(NO3)2 + H2SO4 = PbSO4 + 2 HNO3
1000 cm3
1000 cm3
25 cm3 x
x = 0,05 mól Pb(NO3)2
1 mól Pb(NO3)2 1 mól H2SO4 1 mól PbSO4
0,05 0,05 mól H2SO4 0,05 mól PbSO4
m PbSO4
= 0,05. 303,1 =
mH2SO4 =
0,05 . 98 =
x 4,9
x =
28. Ezüst-nitrát oldathoz sósavat öntve AgCl csapadék
válik le.
Mr AgCl = 143,3 gmól-1
AgNO3 + HCl = AgCl + HNO3
nAgCl = 0,287 /143,3= 0,002
1 mól AgNO3 1 mól HCl 1 mól AgCl
x y 0,002
x= 0,002 mól AgNO3 y = 0,002 mól HCl
1000 cm3
1000 cm3
x 0,002
x = 20 cm3
50 cm3 oldatban 0,002 mól AgNO3
1000 cm3 x
x = 0,04 mól
AgNO3
29. Hány cm3
AgNO3 + HCl = AgCl + HNO3
AgCl + 2 NH4OH = [Ag(NH3)2]Cl + 2 H2O
1000 cm3 1M 1 NH4OH
50 cm 1M x
x = 0,05 mól NH4OH
1 mól AgCl 2 mól NH4OH
x 0,05
x = 0,025 mól AgCl
1mól HCl 1 mól AgNO3 1 mól AgCl
x y 0,025
x = 0,025 mól HCl y = 0,025 mól AgNO3
1000 cm3 1M 1 mól AgNO3
1000 cm3 0,1M 0,1 mól AgNO3
x
x = 250 cm3
1000 cm3 1M 1 mól HCl
1000 cm3 2M 2 mól
y 2M 0,025
y = 12,50 cm3 2M HCl
30. Azonos töménységü: 1 mól/ dm3 töménységü
és azonos térfogatú AgNO3 és KBr oldat összeöntésekor
MrAgBr = 187,7 gmól-1
AgNO3 + KBr = AgBr + KNO3
nAgBr = 4,7 /187,7
nAgBr = 0,025
1 mól AgNO3 1 mól KBr 1 mól AgBr
x y 0,025
x = 0,025 mól AgNO3 y = 0,025 mól KBr
1000 cm3 1M 1 mól AgNO3 1 mól KBr
x 0,025 0,025
x = 25 cm3
31. Egy sósav oldat pH-ja 2,7. Hány mólos ez az oldat?
pH = -lg [H+] = 2,7
lg[H+] = -2,7
[H+] = 10-2,7
[H+] = 100,3-3 = 100,3 ˇ 10-3 = 1,99 ˇ 10-3
32. Mennyi annak az oldatnak a pH-ja, amelynek 100 cm3-ében 0,03 mól NaOH van ?
NaOH erös bázis , így NaOH OH
100 cm3 oldatban 0,03 mól OH
1000 cm3 x
x = 0,3 mól OH /dm3
pOH = - lg OH = - lg 0,3
pOH = 0,52
pH = 14,00 - 0,52 = 13,48
33. Mennyi lesz annak az oldatnak a pH-ja, amelyet úgy
készítettünk, hogy 1 dm3
HCl H =
Oldat térfogata : 1dm3 HCl oldat + 1 dm3 víz = 2 dm3 = 2000 cm3
2000 cm3 oldatban
1000 cm3 x
X = 0,05 mól H
pH = - lg 0,05
pH = 1,30
34. Mennyi a 0,3 mólos NaOH oldat pH-ja?
14 = pH + pOH
[OH-] = 0,3
pOH = - lg 3 ˇ 10-1
pOH = 0,53
pH = 14 - 0,53 = 13,47
vagy: [H+][OH-] = 10-14
[H+]
= ![]() = 3,3 ˇ 10-14
= 3,3 ˇ 10-14
35. Mennyi a 0,01M HCl oldat OH--koncentrációja?
A sósav erős sav, ezért vizes oldatban 100%-os a disszociáció. A H+-koncentrációja tehát azonos a sósav-oldat molaritásával, [H+] = 0,01M.
A víz ionszorzata segítségével:
Kv = [H+] [OH-] = 1 ˇ 10-14
[OH-]
= ![]() mol/dm3
mol/dm3
36. Mennyi a pH-ja annak a 0,2 mólos egyértékü gyenge savoldatnak, amelynek a disszociáció foka a = 0,1
H = a csav
H = 0,1
pH = - lg 0,02
pH = 1,70
37. Mennyi annak az oldatnak a H -ja, amelynek a pH értéke 3,70
pH = - lg H
pH = 3,70
- lg H
lg H
H
H = 2 10-4 mól/dm3
38. Mekkora a pH-ja annak az NH4OH oldatnak,
amely dm3-enként
NH3 + H2O = NH4OH
1000 cm3 1M
1000 cm3 x
X = 1,41 mól
1,41 NH3 = 1,41 mól NH4OH
OH 2= Kb cb
OH
OH = 5,02
pOH = - lg 5,02
pOH = 2,29
pH = 14,00 - pOH = 14,00 - 2,29
pH = 11,71
39. 150 cm3
M rCH3COOH = 60 gmól-1
1000 cm3 1M 1 mól CH3COOH
1000 cm3
150 cm3
x = 0,075 mól CH3COOH
250 cm3 0,075 mól CH3COOH
1000 cm3 x
x = 0,3 mól/dm3 CH3COOH
H = Ks Csav
H =1,86
H = 2,36
pH = - lg 2,36
pH = 2,62
40. Mennyi a 0,1M ecetsav pH-ja, ha a disszociáció% 1,3?
A disszociáció%-ból a H+-koncentráció számítható:
[H+] = ![]() [HA]össz = 0,013 ˇ 0,1M = 0,0013M
[HA]össz = 0,013 ˇ 0,1M = 0,0013M
pH = - log [H+] = - log 0,0013 = 2,89
41. Számítsuk ki egy 10-7 mólos sósavoldat pH-ját! A víz disszociációjából származó [H+] nem hanyagolható el.
A vízből származó [H+] = x A vízből származó [OH-] = x
Az összes hidrogénion koncentráció 10-7 + x (A sav miatt a víz [H+]-ja visszaszorulhat bizonyos mértékben.)
Tehát [OH-] [H+] = 10-14 = [10-7 + x] [x] = x2 + 10-7 x
x2 + 10-7 x - 10-14 = 0
A másodfokú
egyenlet megoldó képletébe (x1,2 = ![]() )
behelyettesítve:
)
behelyettesítve:
x = 0,618 ˇ 10-7
[H+] = 10-7 + x = 10-7 + 0,618 ˇ 10-7
[H+] = 1,618 ˇ 10-7 grammion/liter (1 ˇ 10-7 helyett)
pH = 6,79
Hibás megoldás lesz: [H+] = 2 ˇ 10-7
pH = 6,7
Ahol a vízböl és a savból származó [H+]: 10-7 + 10-7 = 2 10-7 számértékkel van figyelembe véve.
42. Mekkora a pH-ja annak az oldatnak, amelyet 1 dm3 5 m/m%-os NaOH , amely sürüsége 1,054 g/cm3 és 1dm3 1,020 g/cm3 sürüségü HCl oldat elegyítésével készítettünk és a keletkezett oldat sürüsége 1,019 g/cm3
MrNaOH=40 gmól-1 MrHCl=36,5 gmól-1
NaOH oldat tömege: m = V r = 1000 cm3 1,054 g/cm3 =
1054 x
x
=
HCl oldat tömege : m = V r = 1000 cm3 1,020 g/cm3 =
1020 x
x
=
HCl + NaOH = NaCl + H2O
1 mól 1 mól
1,1178 1,1178
Marad : 1,3175 - 1,1178 = 0,1997 mól NaOH
Oldat tömege : 1054 + 1020 = 2074, oldat térfogata V = m/r = 2074 g/ 1,019 g/cm3 = 2035,2 cm3
2035,2 cm3 oldatban 0,1997 mól NaOH
1000 cm3 x
x = 0,0981 mól/dm3
pOH = - lg 0,0981
pOH = 1,008
pH = 14.00 - 1,008
pH = 12,992
43. Mennyi a
A kénsav kétértékü sav, tehát 2 H+ keletkezik a disszociáció miatt:
[H+] = 0,04
pH = -lg 4 ˇ 10-2 = 2 - lg 4 = 2 - 0,6021
44. Mennyi az 1 mólos NH4OH oldat pH-ja, ha az NH4OH disszociáció állandója K = 1,87 ˇ 10-5?
![]() NH4OH
NH4OH ![]() + OH-
+ OH-
K
= ![]()
A disszociált NH4OH
koncentrációja = ![]()
A disszociálatlan NH4OH koncentrációja = bemért [NH4OH] - disszociált [NH4OH]
1,87 ˇ 10-5
= ![]()
Az 1 mellett a [OH-] igen kicsiny volta miatt elhanyagolható.
[OH-]2 = 1,87 ˇ 10-5 grammion/liter
[OH-] =
![]()
lg [OH-] = - ![]() + 1/2 lg 18,7 = - 2,364
+ 1/2 lg 18,7 = - 2,364
pOH = 2,364
pH = 14 - 2,364 = 11,636
45. Mennyi annak az ecetsavoldatnak a pH-ja, amelynek 1 litere 0,1 mol ecetsavat tartalmaz? (Ks = 1,80 ˇ 10-5)
Az ecetsav egyensúlyi állandója megadható a disszociációs egyensúlyra:
Ks = ![]() = 1,8 ˇ 10-5
= 1,8 ˇ 10-5
Egyensúlyi állapotban:
[H+] = [CH3COO-] = x
[CH3COOH] = 0,1 - x (az ecetsav koncentrációja 0,1M)
Behelyettesítve:
1,80 ˇ 10-5
= ![]()
x2 + (1,80ˇ10-5)x - 1,80ˇ10-6 = 0
Alkalmazva a másodfokú egyenlet megoldási képletét:
x1,2 = ![]()
(a másodfokú egyenlet ax2 + bx + c = 0)
x = ![]() = 1,33 ˇ 10-3
= 1,33 ˇ 10-3
[H+] = 0,00133
-lg [H+] = pH = 2,88
Ha a megoldás során x értéket elhanyagoljuk (ami megtehető, mert x lényegesen kisebb 0,1-nél):
1,80 ˇ 10-5 =
![]() , mivel 0,1 - x
, mivel 0,1 - x
x2 = 1,80 ˇ 10-6
x = 1,34 ˇ 10-3
[H+] = 0,00134; pH = 2,87
A közelítö megoldás jól egyezik a pontosabb számítással, tehát hsználható.
46. Számítsuk ki az 1 mólos NH4OH oldat pH-ját!
Kb NH4OH = 1,87 ˇ 10-5
![]() NH4OH
NH4OH ![]() + OH-
+ OH-
Kd
= ![]()
Kd
= ![]()
[OH-] = ![]() =
= ![]()
pOH = - lg ![]() = 2,36
= 2,36
pH = 14-2,36 = 11,64
47. Egy liter vizes oldat 0,25 mol Na-acetát és 0,35 mol ecetsav felhasználásával készült. Mekkora az oldat pH-ja? Az ecetsav diszociációs állandója szobahőmérsékleten: Ks = 1,753 ˇ 10-5.
pH = pKs + lg ![]() = 4,7562 + lg
= 4,7562 + lg ![]() = 4,6101
= 4,6101
pKs = - lg Ks
= 4,7562 log![]() = log 0,7143 =
-0,1461
= log 0,7143 =
-0,1461
48. Egy nátrium-acetát/ecetsav puffer esetén mind a só, mind a sav bemérési koncentrációja 0,75 mol/dm3. Mekkora a pH-változás, ha az oldathoz annyi sósavat adunk, hogy annak koncentrációja az oldatban 0,03 mol/dm3 lesz (pKs = 4,76)?
pH = pKs
+ lg ![]() = 4,76 + log
= 4,76 + log ![]() = 4,76
= 4,76
DpH = lg ![]() = 0,035
= 0,035
49. Milyen mértékben változik meg
Az ecetsavnál Ks = 1,8 ˇ 10-5.
pH = pKs +
log ![]() = 4,74 + log
= 4,74 + log ![]() = 4,74
= 4,74
(pKs = - log Ks)
Az erős bázis hatására lejátszódó reakció:
![]() CH3COOH(aq)
+ OH- CH3COO- + H2O(l)
CH3COOH(aq)
+ OH- CH3COO- + H2O(l)
0,005 mol 0,005 mol 0,005 mol
A mól mennyiségek figyelembevételével változnak a pufferpár koncentrációi:
csökken [CH3COOH] = (0,1 - 0,005) mol/dm3 = 0,095 mol/dm3
növekszik [CH3COO-] = (0,1 + 0,005) mol/dm3 = 0,105 mol/dm3
Behelyettesítve az előző egyenletbe:
pH = 4,74 + log ![]() = 4,78
= 4,78
Tehát 0,005 mol KOH a puffer pH-ját csak 0,04 egységgel növelte. Ehhez hasonlóan 0,005 mol erős sav (pl. sósav) fenti puffer 1 literének pH-ját csak 0,04 egységgel csökkenti.
50. Milyen formiát/hangyasav arány szükséges pH = 3,80 hangyasav-nátrium-formiát pufferoldathoz? A hangyasavnál Ks = 1,77 ˇ 10-4
![]() A hangyasav disszociációja: HCOOH(aq) H+ + HCOO-
A hangyasav disszociációja: HCOOH(aq) H+ + HCOO-
Ks = 1,77 ˇ 10-4 pKs = 3,75
Alkalmazva a pufferek pH-jára levezetett egyenletet:
pH = pKs +
log ![]()
log ![]() = 3,80 - 3,75 = 0,05
= 3,80 - 3,75 = 0,05
![]() = 1,12
= 1,12
A formiát/hangyasav arány 1,12
Pl.: 1M HCOOH és 1,12M HCOONa
51. 1 dm3 9-es pH-jú pufferoldatot kell készíteni 298 K-on. 0,5 dm3 1 molˇdm-3 koncentrációjú NH4OH oldatba hány g NH4Cl-t mérjünk be? Kb (NH4OH) = 1,87 ˇ 10-5 molˇdm-3, Mr (NH4Cl) = 0,05355 kgˇmol-1.
A szükséges mennyiségű NH4Cl bemérése után olyan pufferelegyünk lesz, melyben a gyenge elektrolit (jelen esetben NH4OH) disszociációja a jelenlevő erős elektrolit (só) miatt visszaszorul.
Kb
= ![]()
Fentiek miatt [NH4OH]
= [bázis] és [![]() ] = [só]
] = [só]
Kb = ![]() [só] = Kb
[só] = Kb
![]()
Esetünkben pH = 9
miatt [H+] = 1 ˇ 10-9 molˇdm-3. Mivel 298 K-on Kv =
1 ˇ 10-14 (molˇdm-3), [OH-] =
1 ˇ 10-5 mol dm-3, továbbá [bázis] = 0,5 molˇdm-3.
A fenti adatok behelyettesítésével:
[só] = 1,87 ˇ 10-5
molˇ dm-3 ![]() = 0,935 molˇdm-3
= 0,935 molˇdm-3
Vagyis a pufferoldatban 0,935 molˇdm-3-nek kell az NH4Cl koncentrációnak lenni.
m = 0,935 molˇdm-3ˇ0,05355 kgˇmol-1 = 0,05007 kgˇdm-3
Vagyis
52.Mekkora annak a pufferoldatnak a pH-ja, amely 0,01 mól/dm3 koncentrációban tartalmaz CH3COOH-t és CH3COONa-t ?
KsCH3COOH = 1,86
H = Ks csav/csó
H
pH = - lg 1,86
pH = 4,74
53. Mekkora annak a pufferoldatnak a pH-ja, amely 100 cm3
0,05 mól/dm3 NH3
oldatból és
KbNH4OH = 1,86 , MrNH4Cl = 53,5 gmól-1
nNH4OH = 0,3/53,5 = 0,0056
100 cm3 0,0056 mól NH4Cl
1000 cm3 x
X = 0,056
pOH = Kb cbázis/ csó
pOH = 1,86
pOH = 1,60
pOH = 4,79
pH = 14,00 - 4,79
pH = 9,21
54. 700 cm3
KsCH3COOH = 1,86 MrNaOH = 40 gmól-1
1000 cm3
700 cm3 x
x = 0,0021 mól CH3COOH
55 mg NaOH =
nNaOH = 0,055 / 40 = 0,001375
1mól NaOH 1 mól CH3COOH 1 mól CH3COONa
0,001375 0,001375 0,001375
CH3COOH maradék : 0,0021 - 0,001375 = 0,000725 mól
700 cm3 0,001375 mól CH3COONa 0,000725 mól CH3COOH
1000 cm3 x y
x = 0,00196 y = 0,00103
H = Ks csav/csó
H
H
pH = - lg 9,45
pH = 5,03
15. 2 Megoldandó feladatok
Hány g NaCl szükséges
MrNaCl = 58,5 gmól-1 MrH2O
= 18 gmól-1
Hány mólos a 20,21 m/m %-os sósav oldat r = 1,10 g/cm3. Hány m/v %-os és
mennyi a koncentrációja n/n %-ban?
MrHCl =
Egy oldat
MrKOH = 56 gmól-1
Hány mólos a 34 m/m %-os HBr oldat, ha sürüsége 1,36 g/cm3.
Mennyi a koncentrációja m/v %-ban és n/n %-ban.
MrHBr = 80,9 gmól-1 MrH2O
= 18 gmól-1
Hány cm3 r = 1,84 g/cm3 sürüségü 96 m/m %-os H2SO4 kell 5 dm3 18 m/m %-os r = 1,29 g/cm3 sürüségü H2SO4 elöállításához?
Hány m/v %-os és hány mólos az 50
m/m %-os HNO3, ha sürüsége 1,35 g/cm3.
MrHNO3 = 63 gmól-1
Hány m/v %-os és hány mólos a 60
m/m %-os H2SO4, ha sürüsége r = 1,64 g/cm3.
MrH2SO4 = 98 gmól-1
Hány m/v % és mólos a 65 m/m %-os
HClO4 oldat, ha a sürüsége 1,30 g/cm3.
MrHClO4 = 100,47 gmól-1
Mennyi a 65 m/v %-os HNO3 oldat koncentrációja mól/dm3 és tömeg %-ban, ha r = 1,40 g/cm3? MrHNO3 = 63 gmól-1
Egy oldat Na2CO3-ot tartalmaz. Semlegesítéséhez 15 cm3 0,05 mólos H2SO4 kell. Hány mg Na2CO3 van az oldatban?MrNa2CO3 = 106 gmól-1 , MrH2SO4 = 98 gmól-1
10 cm3 ismeretlen koncentrációjú COOH - COOH semlegesítéséhez 44 cm3 0,1 mólos NaOH hidroxid kell.Hány m/v % az oldat és mennyi a koncentrációja mól/dm3-ben.Mr(COOH)2 = 90 gmól-1 , MrNaOH = 40 gmól-1
Hány g KOH
semlegesít 20 cm3 0,2 Mólos H2SO4 oldatot.
MrH2SO4 = 98 gmól-1 , MrKOH
= 56 gmól-1
20 cm3
oldatban ismeretlen mennyiségü salétromsav van. Semlegesítéséhez 32 cm3
MrHNO3 = 63 gmól-1 MrNaOH
= 40 gmól-1
Egy H2SO4
oldat 20 cm3-nek semlegesítéséhez 25 cm3
MrH2SO4 = 98 gmól-1 MrKOH
= 56 gmól-1
2000 cm3
MrHCl = 36,5 gmól-1
Mekkora a pH-ja a 0,1 mólos HCl-nak?
Mekkora a pH-ja az 5 10-4 mól/dm3 koncentrációjú kénsavnak? (Tételezzük fel, hogy a H2SO4 teljesen disszociál)
Mekkora annak
az oldatnak a pH-ja, amelyet úgy készítettünk, hogy 1 cm3
r = 1,185 g/cm3 sürüségü 37 m/m %-os HCl-ot 5
dm végtérfogatra hígítottunk!
MrHCl = 36,5 gmól-1
3 dm3 pH = 2,00 oldat elöállításához mekkora térfogatú
20 m/m %-os r = 1,1 g/cm3
sürüségü HCl szükséges?
MrHCl = 36,5 gmól-1
pH = 1,00 erös savból készült oldatot 10-szeresére hígítjuk. Mekkora a keletkezö oldat pH-ja?
Összeöntünk azonos térfogatú pH = 1,00 és pH = 2,00 sósavat. Mennyi a keletkezö oldat pH-ja?
Mekkora a pH-ja 25 C-on az 5 10-3 mól/dm3-es NaOH oldatnak?
MrNaOH = 40 gmól-1
2 dm3
pH = 11,50 oldat elöállításához mennyi NaOH-ra van szükség?
MrNaOH = 40 gmól-1
Rendelkezésünkre áll 100 cm3 5 m/m %-os r = 1,05 g/cm3 sürüségü NaOH oldat. Mekkora térfogatú pH = 13,00 oldat készíthetö belöle?
10,00 cm3 pH = 1,00 sósavat 10,00 cm3 NaOH semlegesít. Mekkora a NaOH koncentrációja mól/dm3-ben?
10,00 cm3 pH = 12,00 NaOH oldatot mekkora térfogatú pH = 1,00 HCl oldat semlegesít?
Egy gyenge
sav
Mennyi a pH-ja a benzoesav
Mennyi a pH-ja a piroszölösav
Hány mólos a 17 m/m % NH3 oldat, ha a sürüsége 0,98 g/cm3. Mennyi az oldat pH-ja, ha Ks = 1,8 10-5? MrNH3 = 17 gmól-1
Mennyi annak
az oldatnak a pH-ja, amely úgy készült, hogy 69 cm3 96 m/m %
r = 1,05 g/cm3 sürüségü ecetsavat 1000 cm3-re
hígítottuk. Ks = 1,86 10-5
MrCH3COOH = 60 gmól-1
Hány cm3 30 m/m %-os r = 0,892 g/cm3 sürüségü NH3 oldatra van szükség 1,0 dm3 pH = 11,00 oldat elöállításához? Ks = 1,8 10-5 MrNH3 = 17 gmól-1
Mekkora térfogatú 96 m/m %-os r = 1,05 g/cm3 sürüségü CH3COOH szükséges 3 dm3 pH = 4,00 oldat elöállításához? Ks = 1,86 10-5 MrCH3COOH = 60 gmól-1
Mekkora annak az oldatnak a pH-ja, amely 0,01 mól/dm3 koncentrációban tartalmaz ecetsavat és nátrium-acetátot? Ks = 1,86
Mekkora az NH3
és NH4Cl-re nézve egyaránt
Mekkora annak az oldatnak a pH-ja, amely 100 cm3 0,050 mól/dm3
HN3 oldatból és
(Az oldódás során bekövetkezö térfogatváltozást elhanyagoljuk.)
Mekkora annak
az oldatnak a pH-ja, amelyet úgy készítettünk, hogy 250 cm3 0,040
mól/dm3 ecetsavban
100 cm3 0,100 mól/dm3 nátrium-acetát és 50 cm3 0,050 mól/dm3 ecetsav összeöntésekor milyen pH-jú puffer keletkezik? Ks = 1,86
100 cm3 0,1 mól/dm3-es NaOH és 150 cm3 0,1 mól/dm3 ecetsav összeöntésekor mekkora pH-jú puffer keletkezik? Ks = 1,86
150 cm3 0,1 mól/dm3-es ammóniaoldat és 50 cm3 0,2 mól/dm3 sósav elegyítésekor mekkora keletkezö oldat pH-ja? Ks = 1,86
500 cm3 0,01
mól/dm3 sósavhoz 5 cm3 28 m/m %-os r = 0,898 g/cm3 sürüségü ammonia oldatot
öntünk. Mekkora a keletkezett oldat pH-ja?
Ks = 1,86 10-5 MrNH3 = 17 gmól-1
Mennyi a 0,3 mól ecetsavat és 0,5 mól nátrium-acetátot tartalmazó
puffer 1 dm3-ének a pH-ja?Ks = 1,86 10-5
Mekkora lesz a pH, ha az oldatot 3 dm3-re hígítom!
Számítsuk ki az olyan pufferoldat pH-ját, amely ecetsavra nézve 0,02
M-os, nátriumacetátra nézve 0,04 M-os! Ks
= 1,86 10-5
Ha az oldat 1 dm3 2 dm3-re hígítom, mekkora lesz a pH?
1 dm3
MrNaOH = 40 gmól-1 MrCH3COOH
= 60 gmól-1 Ks
= 1,86
Mennyi annak az oldatnak a pH-ja, amelyet úgy kapunk, hogy összeöntünk
450 cm3
Mennyi az oldat pH-ja, ha 60 cm3
400 cm3
50. Hány m/m %-os a 24 m/v %-os glükóz oldat, ha sürüsége 1,12 g/cm3. Mennyi a koncentrációja mól/dm3 és n/n %-ban. MrC6H12O6 = 180 gmól-1 MrH2O = 18 gmól-1
Melléklet: Fontosabb táblázatok jegyzéke
1. táblázat. A nyomás mértékegységeinek átszámítása
|
|
Pa |
bar |
atm |
Hgmm (torr) |
|
1 Pa |
1 |
10 E-5 |
9.87ˇ10 E-6 |
7.50ˇ10.E-3 |
|
1 bar |
10 E5 |
1 |
0.987 |
750 |
|
1 atm |
1.01325ˇ10 E5 |
1.013 |
1 |
760 |
|
1 Hgmm (torr) |
133.3 |
1.333.10 E-3 |
1.316.10 E-3 |
1 |
2.táblázat. A munka, az energia és a höenergia egységeinek átszámítása
J kp.m LE.h kW.h l.atm kcal
1 J 1 0.102 3.777 2.778 9.87.10 E-3 2.390.
.10 E-7 .10 E-7 10 E-4
1 kp.m 9.81 1 3.704. 2.724. 9.68.10 E-2 2.34.
10 E-6 10 E-6 10 E-3
1 LE.h 2.65. 2.7. 1 0.7355 2.62.10 E4 597
10 E6 10 E5
1 kW.h 3.6. 3.67. 1.36 1 3.55.10 E4 860
10 E6 10 E5
l l.atm 101.3 10.33 3.82. 2.81 1. 2.42.
10 E-5 10 E-5 10 E-2
__________ ______ ____ __________ ______ ____ _____ 1 kcal 4184 427 1.58. 1.163. 41.32 1
10 E-3 10 E-3
Találat: 4425