| kategória | ||||||||||
|
|
||||||||||
|
|
||
Gázfázisban az addíciós folyamat leggyakrabban gyökös mechanizmus (AdR) szerint játszódik le. A reakció elsö lépésében az XY reagens homolítikus bomlásából származó szabad gyök, például az X az olefin p-kötését homolitikusan hasítja.
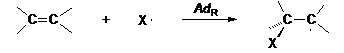
A képzödött gyök részint láncreakcióban reagálhat az XY reagenssel, miközben újratermelödik az X , részint pedig reagálhat egy másik olefinnel, ami egy poliaddíciós (polimerizációs) folyamat elindulását jelenti.

A konjugált diének közül a 2-metilbuta-1,3-dién (izoprén) 1,4-poliaddíciójával rugalmas láncmolekula képzödik. Ennek szerkezete megegyezik a természetben elöforduló kaucsuk szerkezetével. Az izoprén számos biológiailag fontos természetes anyag építököve (l. ???. old.).
Az etén a szerves vegyipar legnagyobb mennyiségben gyártott terméke. Földgázból és köolajból krakkolással állítják elö. Az etént az iparban nagyon változatos módon használják fel, a szintetikus vegyipar termékeinek jelentös része az etén vagy az eténböl nyert különbözö származékok felhasználásával készül. Így a már említett polimerizációs müanyagok mellett többek között az etilén-oxid, etilénglikol, etanol, vinil-acetát, acetaldehid, ecetsav, etil-klorid gyártásának kiindulási anyaga.
Találat: 3189